新疆博尔塔拉蒙古自治州第五师高级中学2019-2020学年高二上学期第一次月考化学试题(1)
化学试卷
一.选择题
1.已知吸热反应2CO(g)= 2C(s)+O2(g) ,设ΔH 和ΔS不随温度而变,下列说法中正确的是( )
A.低温下能自发进行 B.高温下能自发进行
C.任何温度下都能自发进行 D.任何温度下都不能自发进行
2.下列反应中,既属于氧化还原反应同时又是吸热反应的是( )
A. Ba(OH)2·8H2O与NH4Cl反应 B. 灼热的碳与高温水蒸气的反应
C. 铝与稀盐酸 D. H2与O2的燃烧反应
3.下列说法或表示方法正确的是
A. 等物质的量的硫蒸气和硫固体分别完全燃烧,后者放出热量多
B. 由“C(石墨)=C(金刚石)△H =+1.9kJ/mol”可知,金刚石比石墨稳定
C. 在l0lkPa时,2gH2完全燃烧生成液态水放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O⑴:△H =-285.8kJ/mol。
D. 在稀溶液中,H+(aq)+OH(aq)=H2O(l) △H =-57.3kJ/mol,若将含 lmolCH3COOH 与含1mol NaOH的稀溶液混合,放出的热量小于57.3kJ
4.等质量的铁与过量的盐酸在不同的试验条件下进行反应,测定在不同时间t产生氢气体积V的数据,根据数据绘制得到图甲,则曲线a、b、c、d所对应的试验组别是
组别
c(HCl)(mol·L-1)
温度(℃)
铁的状态
1
2.0
25
块状
2
2.5
30
块状
3
2.5
50
粉末状
4
2.5
30
粉末状
A.3-4-2-1 B. 1-2-4-3 C. 4-3-2-1 D.1-2-3-4
5.对于3W(g) + 2X(g) = 4Y(g) + 3Z(g) ,下列反应速率关系正确的是
A.υ(W) = 3υ(Z) B.2υ(X) = 3υ(Z)
C.2υ(X) =υ(Y) D.3υ(W) = 2υ(X)
6. 在某密闭容器中,可逆反应:A(g)+B(g)xC(g)符合图像(Ⅰ)所示关系。由此推断,对图像(Ⅱ)的不正确的说法是( )
A. p3>p4,y轴表示A的转化率
B. p3>p4,y轴表示B的质量分数
C.p3>p4,y轴表示C的质量分数
D.p3>p4,y轴表示混合气体的平均相对分子质量
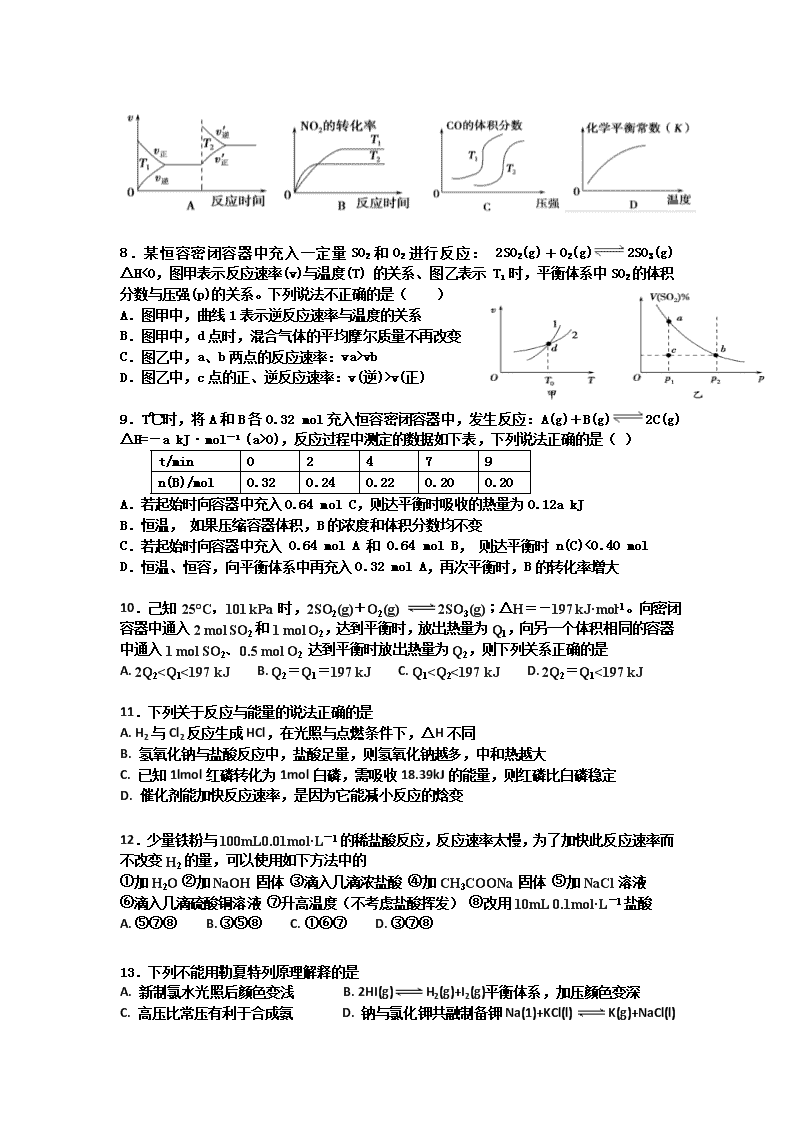
7.对于反应:4CO(g)+2NO2(g)= 4CO2(g)+N2(g) △H=-1200 kJ· mol-1,温度不同 (T2>T1)其他条件相同时,下列图像正确的是( )
8.某恒容密闭容器中充入一定量SO2和O2进行反应: 2SO2(g)+O2(g)2SO3(g) ΔH<0,图甲表示反应速率(v)与温度(T) 的关系、图乙表示 T1 时,平衡体系中SO2的体积分数与压强(p)的关系。下列说法不正确的是( )
A.图甲中,曲线1表示逆反应速率与温度的关系
B.图甲中,d点时,混合气体的平均摩尔质量不再改变
C.图乙中,a、b两点的反应速率:va>vb
D.图乙中,c点的正、逆反应速率:v(逆)>v(正)
9.T℃时,将A和B各0.32 mol充入恒容密闭容器中,发生反应:A(g)+B(g)2C(g) △H=-a kJ·mol-1 (a>0),反应过程中测定的数据如下表,下列说法正确的是( )
t/min
0
2
4
7
9
n(B)/mol
0.32
0.24
0.22
0.20
0.20
A.若起始时向容器中充入0.64 mol C,则达平衡时吸收的热量为0.12a kJ
B.恒温, 如果压缩容器体积,B的浓度和体积分数均不变
C.若起始时向容器中充入 0.64 mol A 和 0.64 mol B, 则达平衡时 n(C)<0.40 mol
D.恒温、恒容,向平衡体系中再充入0.32 mol A,再次平衡时,B的转化率增大
10.己知 25°C,101 kPa 时,2SO2(g)+O2(g) 2SO3(g);△H=-197 kJ·mol-1。向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2、0.5 mol O2 达到平衡时放出热量为Q2,则下列关系正确的是
A. 2Q2
3,达到平衡后B的转化率关系为:
D.x不论为何值,平衡时M、N中的平均相对分子质量都相等
二,填空题
21.(8分)在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量的N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256.65kJ的热量。
(1)写出该反应的热化学方程式__________________________________________。
(2)已知H2O(l)====H2O(g);△H=+44kJ·mol-1,则16 g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ。
(3)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是________________________。
(4)已知N2(g)+2O2(g)====2 NO2(g);△H=+67.7 kJ·mol-1, N2H4(g)+O2(g)=== N2(g)+2H2O (g);△H=—534 kJ·mol-1,根据盖斯定律写出肼与NO2完全反应生成氮气和气态水的热化学方程式_____________________。
22.(10)二甲醚(CH3OCH3)被称为21世纪的新型燃料,25℃,101kPa时呈气态,它清洁、高效、具有优良的环保性能。92g气态二甲醚25℃,101kPa时燃烧放热2910kJ。
(1)转移的电子数为______________________________。
(2)已知H2(g)和C(s)的燃烧热分别是285.8kJ/mol、393.5kJ/mo;计算反应4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热为_________________;
(3)工业利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)⇌CH3OCH3(g)+3H2O(g)△H<0
①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是_________________(选填字母编号)
A.c(H2)与c(H2O)的比值保持不变
B.单位时间内有2mol H2消耗时有1mol H2O生成
C.容器中气体密度不再改变
D.容器中气体压强不再改变
E.反应产生的热量不再变化
②温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产量将________(填“变大”、“变小”或“不变”,下同),混合气体的平均摩尔质量将_________________。
23.(16)硫酸是重要的化工原料,生产过程中SO2催化氧化生成SO3的化学反应为:
2SO2(g)+O2(g) 2SO3(g)。
(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是________。
SO2 压强
转化率
温度
1个大气压
5个大气压
10个大气压
15个大气压
400℃
0.9961
0.9972
0.9984
0.9988
500℃
0.9675
0.9767
0.9852
0.9894
600℃
0.8520
0.8897
0.9276
0.9468
(2)反应2SO2(g)+O2(g) 2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
A.保持温度和容器体积不变,充入1molO2(g)
B.保持温度和容器体积不变,充入2mol SO3(g)
C.降低温度
D.在其他条件不变时,减小容器的容积
(3)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。2.0 molSO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”), B点的化学平衡常数是______。
(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10molO2, t1时刻达到平衡,测得容器中
含SO30.18mol。
① tl 时刻达到平衡后,改变一个条件使化学反应速率发生如图所示的变化,则改变的条件是________。
A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容器体积
D.升高温度
E.体积不变,向容器中通入少量氮气
② 若继续通入0.20mol SO2和0.10molO2,则平衡________移动(填“向正反应方向”、“向逆反应方向”或“不”) ,再次达到平衡后,______mol<(nSO3)<______mol。
三计算题(6分)
24.恒温恒容下,将 2 mol 气体 A 和 2 mol 气体 B 通入体积为 2L 的密闭容器中,发生如下反应:2A(g)+B(g) XC(g)+2D(s),2 min 后反应达到平衡状态,此时剩余 1.2 mol B,并测得 C 的浓度为 1.2 mol/L。
(1)求 X 的值__________;
(2)A 的转化率为___________;
(3)平衡前后的气体的压强之比为___________
(化学答案)
一选择题
1
2
3
4
5
6
7
8
9
10
D
B
D
A
C
B
B
C
D
A
11
12
13
14
15
16
17
18
19
20
C
D
B
C
C
D
C
C
B
B
二、非选择题(40分)
(9分)
21(1) -641.6 。
(2) 408.8 kJ。
(3) 无污染
(4) -1135.7 。
22(1)___4.8________________。
(2)_____-378.8____________;
(3) ①___ADE_____(选填字母编号)
②___变小_____(填“变大”、“变小”或“不变”,下同),_____变_小___________
23.(8分) (1)1个大气压和400℃
(2) A、C 。
(3) = 800
(4) ①C
② 正向
0.36 mol<(nSO3)<__ 0.4_mol
24.
(1)求 X 的值 3 ;
(2)A 的转化率为 80% ;
(3)平衡前后的气体的压强之比为___1:1__