- 2021-07-02 发布 |
- 37.5 KB |
- 42页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
山东版2021高考化学一轮复习专题四氧化还原反应课件
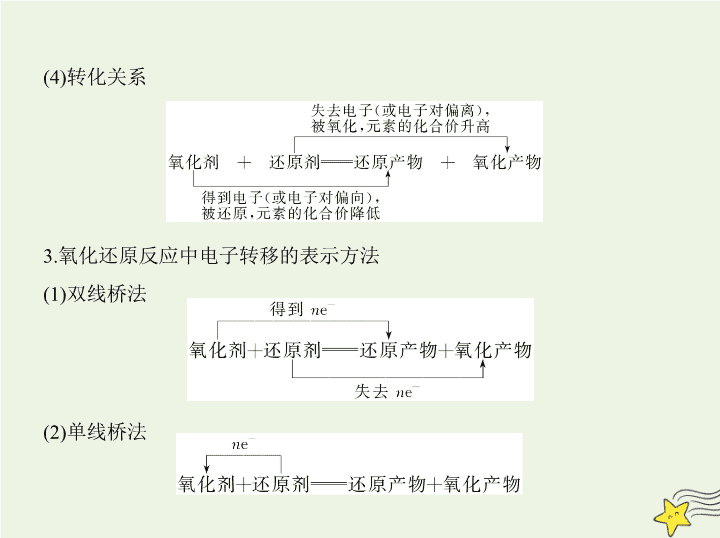
考点 清单 考点一 氧化还原反应的概念及规律 1.氧化还原反应的本质和判断依据 (1)氧化还原反应的本质:电子① 转移 (电子得失或电子对偏移)。 (2)判断依据:元素化合价② 升高或降低 。 2.氧化还原反应中的有关概念 (1)氧化反应和还原反应 氧化反应和还原反应是指氧化还原反应中的两个方面,二者同时存在,不能 独自发生。 氧化反应是指反应物③ 失去电子 (反应物所含某元素化合价升高)的反应。 还原反应是指反应物④ 得到电子 (反应物所含某元素化合价降低)的反应。 (2)氧化剂和还原剂 氧化剂是指⑤ 得到 电子(或电子对偏向)的物质,在反应时所含元素的 化合价降低。 还原剂是指⑥ 失去 电子(或电子对偏离)的物质,在反应时所含元素的 化合价升高。 (3)氧化产物和还原产物 氧化产物:还原剂失电子后生成的产物,指含有化合价⑦ 升高 的元素的 产物。 还原产物:氧化剂得电子后生成的产物,指含有化合价⑧ 降低 的元素的 产物。 (4)转化关系 3.氧化还原反应中电子转移的表示方法 (1)双线桥法 (2)单线桥法 注意事项 (1)箭头必须由还原剂中失电子的元素指向氧化剂中得电子的 元素。 (2)箭头方向表示电子⑨ 转移的方向 。 (3)在“桥”上标明转移的⑩ 电子总数 。 4.氧化还原反应的基本规律 (1)守恒规律 氧化还原反应中有物质失电子必有物质得电子,且得电子总数等于失电子 总数。或者说氧化还原反应中,有元素化合价升高必有元素化合价降低,且 化合价降低总值必等于升高总值。 应用:配平氧化还原反应方程式并进行有关计算。 (2)强弱规律 氧化性较强的氧化剂跟还原性较强的还原剂反应,生成还原性较弱的还原 产物和氧化性较弱的氧化产物。 (较强氧化性)(较强 应用:在适宜条件下,用氧化性较强的物质制备还原性较弱的物质,或用还原性较强的物质制备氧化性较弱的物质,也可用于比较物质间氧化性或还原性的强弱。 (3)价态规律 元素处于最高价态,只有氧化性;元素处于最低价态,只有还原性;元素处于 中间价态,既有氧化性又有还原性,但主要表现一种性质。物质中若含有多 种元素,其性质是这些元素性质的综合体现。 应用:判断元素或物质有无氧化性或还原性。 (4)转化规律 在氧化还原反应中,元素相邻价态之间的转化最容易;同种元素不同价态之 间发生反应,元素的化合价只靠近而不交叉;同种元素相邻价态之间不发生 氧化还原反应。例如: 应用:判断氧化还原反应能否发生及电子转移情况。 (5)难易规律 越易失去电子的物质,失去后就越难得到电子;越易得到电子的物质,得到 后就越难失去电子。一种氧化剂同时和几种还原剂相遇时,优先与还原性 最强的发生反应;同理,一种还原剂同时与多种氧化剂相遇时,优先与氧化 性最强的发生反应。如向FeBr 2 溶液中通入Cl 2 时,发生离子反应的先后顺 序为2Fe 2+ +Cl 2 2Fe 3+ +2Cl - 、2Br - +Cl 2 Br 2 +2Cl - 。 应用:判断物质的稳定性及反应顺序。 考点二 氧化还原反应方程式的配平及相关计算 1.配平氧化还原反应方程式的步骤 (1)一标:标出反应前后变价元素的① 化合价 ; (2)二等:使升价和降价② 总数相等 ; (3)三定:确定含化合价变化的元素的物质的化学计量数; (4)四平:用观察法确定其他各物质的化学计量数; (5)五查:检查反应前后③ 原子 、④ 得失电子 、⑤ 电荷 是否守恒。 2.氧化还原反应的计算依据 进行有关氧化还原反应的计算时,应分析化合价变化,以得失电子守恒为切 入点,计算公式如下: 氧化剂的物质的量 × 变价元素原子的个数 × 化合价的变化值=还原剂的物 质的量 × 变价元素原子的个数 × 化合价的变化值。 3.氧化还原反应常见类型 (1)完全氧化还原型 此类反应的特点是还原剂和氧化剂为不同的物质,参加反应的氧化剂(或 还原剂)全部被还原(或被氧化),有关元素的化合价全部发生变化。例如: 4NH 3 +5O 2 4NO+6H 2 O (2)部分氧化还原型 此类反应的特点是还原剂(或氧化剂)只有部分被氧化(或被还原),有关元 素的化合价只有部分发生变化。例如: MnO 2 +4HCl(浓) MnCl 2 +Cl 2 ↑+2H 2 O (3)自身氧化还原型 自身氧化还原反应可以发生在同一物质的不同元素之间,即同一种物质中 的一种元素被氧化,另一种元素被还原,该物质既是氧化剂,又是还原剂;也 可以发生在同一物质的同种元素之间,即同一种物质中的同一种元素既被 氧化又被还原。例如: 2KMnO 4 K 2 MnO 4 +MnO 2 +O 2 ↑ 3S+6KOH 2K 2 S+K 2 SO 3 +3H 2 O (4)归中反应型 此类反应的特点是同一种元素在不同的反应物中有不同的价态(高价、低 价),反应后转化成中间价态。例如: 4.氧化还原反应中的几个“不一定” (1)某元素由化合态变为游离态时,该元素不一定被还原。因为元素处于化 合态时,其化合价可能为正价,也可能为负价。例如:在反应2H 2 O 2H 2 ↑ +O 2 ↑中,氢元素被还原,而氧元素被氧化。 (2)在氧化还原反应中,非金属单质不一定作氧化剂。例如:在反应H 2 +CuO Cu+H 2 O中,H 2 表现出还原性。 (3)某一原子在反应中得到或失去的电子数越多,其氧化性或还原性不一定 越强。物质的氧化性或还原性的强弱取决于得到或失去电子的难易程度, 而不是数目多少。 (4)含有最高价元素的化合物不一定具有强氧化性。如在HClO中Cl元素的 化合价为+1价,在HClO 4 中Cl元素的化合价为+7价,但HClO的氧化性比 HClO 4 强;再如浓硫酸和Na 2 SO 4 溶液中,S元素均为+6价,但浓硫酸具有强氧 化性,而Na 2 SO 4 溶液无强氧化性。 5.特殊氧化还原反应方程式的配平技巧 (1)歧化型——逆向配平法 反应特点:中间价 高价+低价。这类反应宜选用“逆向配平法”,中间 价态元素原子个数往往是同一元素低价产物和高价产物中该元素原子个 数之和。 (2)归中型——正向配平法 反应特点:高价+低价 中间价。这类反应宜选择“正向配平法”,中间 价态元素原子个数往往是同一元素低价反应物和高价反应物中该元素原 子个数之和。 (3) 缺项型配平法 适合此方法的氧化还原反应方程式的特点是 : 反应物或生成物中缺少某一 种物质 , 一般是反应介质 , 如酸、碱或水等。 配平技巧:先确定含有化合价发生变化的元素的物质的化学计量数,然后根 据原子守恒或电荷守恒确定缺项物质,最后确定其他物质的化学计量数。 知能拓展 一、物质氧化性、还原性强弱的判断 1.根据元素活动性顺序(常见元素)判断 ①金属活动性顺序 ②非金属活动性顺序 2.根据元素在周期表中的位置判断 ①同主族元素(从上到下) 如: ②同周期主族元素(从左到右) 如: 3.根据氧化还原反应的方向判断 氧化剂(有氧化性)+还原剂(有还原性) 还原产物(有还原性)+氧化产物 (有氧化性) 氧化性:氧化剂>氧化产物;还原性:还原剂>还原产物。 4.根据氧化产物的价态高低判断 当含有变价元素的还原剂在相似的条件下作用于不同的氧化剂时,可根据 氧化产物中变价元素价态的高低判断氧化剂氧化性的强弱。 如2Fe+3Cl 2 2FeCl 3 、Fe+S FeS,可以判断氧化性:Cl 2 >S。 5.根据反应所需条件判断 当不同的氧化剂作用于同一还原剂时,如果氧化产物价态相同,可根据反应 条件进行判断。例如: 16HCl(浓)+2KMnO 4 2KCl+2MnCl 2 +8H 2 O+5Cl 2 ↑ ① 4HCl(浓)+MnO 2 MnCl 2 +2H 2 O+Cl 2 ↑ ② 4HCl(浓)+O 2 2H 2 O+2Cl 2 ③ 上述三个反应中,还原剂都是浓盐酸,氧化产物都是Cl 2 ,而氧化剂分别是 KMnO 4 、MnO 2 、O 2 。①式中KMnO 4 常温时可把浓盐酸中的Cl氧化;②式 需要在加热条件下才能完成;③式不仅需要加热,而且还需要CuCl 2 作催化 剂才能完成。由此我们可以得出氧化性:KMnO 4 >MnO 2 >O 2 。 6.根据物质的浓度大小判断 具有氧化性(或还原性)的物质的浓度越大,其氧化性(或还原性)越强,反之, 其氧化性(或还原性)越弱。如氧化性:HNO 3 (浓)>HNO 3 (稀);MnO 2 能与浓盐 酸反应,却不能被稀盐酸还原。 7.根据原电池、电解池的电极反应判断 ①一般情况下,两种不同的金属构成原电池的两极,负极是电子流出的极, 正极是电子流入的极。还原性:负极金属>正极金属。 ②用惰性电极电解混合溶液时,在阴极先放电(得电子)的阳离子的氧化性 较强,在阳极先放电的阴离子的还原性较强。 例1 (2018北京东城高三期末,19)某小组研究Na 2 S溶液与KMnO 4 溶液反 应,探究过程如下。 资料:1.Mn 在强酸性条件下被原还为Mn 2+ ,在近中性条件下被还原 为MnO 2 。 实验序号 Ⅰ Ⅱ 实验过程 实验现象 紫色变浅(pH<1),生成棕褐色沉 淀(MnO 2 ) 溶液呈淡黄色(pH ≈ 8),生成浅 粉色沉淀(MnS) 2.单质硫可溶于硫化钠溶液,溶液呈淡黄色。 (1)根据实验可知,Na 2 S具有 性。 (2)甲同学预测实验Ⅰ中S 2- 被氧化成S 。 ①根据实验现象,乙同学认为甲的预测不合理,理由是 。 ②乙同学取实验Ⅰ中少量溶液进行实验,检验到有S ,得出S 2- 被氧化成 S 的结论,丙同学否定了该结论,理由是 。 ③同学们经讨论后,设计了如下实验,证实该条件下Mn 的确可以将S 2- 氧 化成S 。 a.右侧烧杯中的溶液是 。 b.连通后电流针偏转,一段时间后, (填操作和现象)。 (3)实现Ⅰ的现象与资料1存在差异,其原因是新生成的产物(Mn 2+ )与过量的 反应物(Mn )发生反应,该反应的离子方程式是 。 (4)实验Ⅱ的现象与资料也不完全相符,丁同学猜想其原因与(3)相似,经验 证猜想成立,他的实验方案是 。 (5)反思该实验,反应物相同,而现象不同,体现了物质变化不仅与自身的性 质有关,还与 等因素有关。 解题导引 注意知识活用和实验中变量控制,题目体现对证据推理的素养 考查,认识到真正的反应总是有多因素干扰的。 解析 (1)很明显,Na 2 S中S化合价为-2价,具有还原性;(3)由题意知,生成的 Mn 2+ 与过量的反应物(Mn )发生锰元素归中反应,即2Mn +3Mn 2+ +2H 2 O 5MnO 2查看更多