2017-2018学年吉林省吉林市高二下学期期末考试化学试题(Word版)
2017-2018学年吉林省吉林市高二下学期期末考试
化学试题
考试时间:100分钟 总分:100分
可能用到的相对原子量:H-1 C-12 N-14 O-16 S-32 Ti-48 Ni-59 Cu-64 Zn-65
第 I 卷 (选择题 共40分)
一、选择题(每小题只有一个正确选项,每小题2分,共40分)
1.在配制一定物质的量浓度的盐酸时,下列错误操作可使所配制溶液的浓度偏高的是( )
A.用量筒量取浓盐酸时俯视量筒刻度进行读数
B.溶解搅拌时有液体飞溅
C.定容时俯视容量瓶瓶颈刻度线
D.摇匀后见液面下降,再加水至刻度线
2. 标准状况下,a L氢气在过量的bL氯气中燃烧,所得混合物用100mL3.00mol·L-1的NaOH溶液恰好完全吸收,则氯气的体积b为( )
A.2.24L B. 4.48L C.3.36L D.1.12L
3. 用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
B.1mol FeCl3形成的 Fe(OH)3胶体中,胶体颗粒的数目为NA
C.28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为3NA
D.18g重水(D2O)所含的电子数为10NA
4.关于胶体和溶液的本质区别,下列叙述中正确的( )
A.溶液呈电中性,胶体带电荷
B.溶液中通过一束光线出现明显光路,胶体中通过一束光线没有特殊现象
C.溶液中溶质粒子能通过滤纸,胶体中分散质粒子不能通过滤纸
D.溶液与胶体的本质区别在于分散质微粒直径大小
5.在下列有关离子共存的说法中,正确的是( )
A.能使pH试纸显蓝色的溶液中可能大量存在K+、Ba2+、Cl-、Br-
B.中性溶液中可能大量存在Fe3+、K+、Cl-、SO42-
C.含有大量Fe3+的溶液中可能大量存在SCN-、I-、K+、Br-
D.无色溶液中可能大量存在Al3+、NH4+、Cl-、S2-
6.下列说法正确的一组是( )
①不溶于水的盐(CaCO3、BaSO4等)都是弱电解质
②二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质
③氯化钠水溶液在电流的作用下电离出Na+和Cl-,所以氯化钠是强电解质
④强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
⑤熔融的电解质都能导电
⑥强电解质可能是离子化合物,也可能是共价化合物
A.①③⑤⑥ B.②④⑤⑥
C.只有⑤ D.只有⑥
7.将由NaOH、BaCl2、Al2(SO4)3三种固体组成的混合物溶于足量的水中,充分溶解后,向混合溶液中滴加1mol·L-1的稀硫酸,加入稀硫酸的体积与生成沉淀的质量关系如图所示。下列有关判断正确的是( )
A. AB段发生反应的离子方程式为:Ba2++SO42-=BaSO4↓
B. BC段发生反应的离子方程式为:H++OH-=H2O
C. D点表示的沉淀的化学式为:Al(OH)3
D. E点时溶液中含有大量的AlO2-
8.下列离子方程式正确的是( )
A. 向Na2S2O3溶液中通入足量氯气:S2O32-+ 2Cl2+3H2O=2SO32-+4Cl-+6H+
B. 等物质的量的FeBr2与Cl2反应为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
C. 等物质的量MgCl2、Ba(OH)2和HCl溶液混合:Mg2++3OH-+H+=Mg(OH)2↓+H2O
D. 等体积、等浓度的Ba(OH)2稀溶液与NaHSO4稀溶液混合:
Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
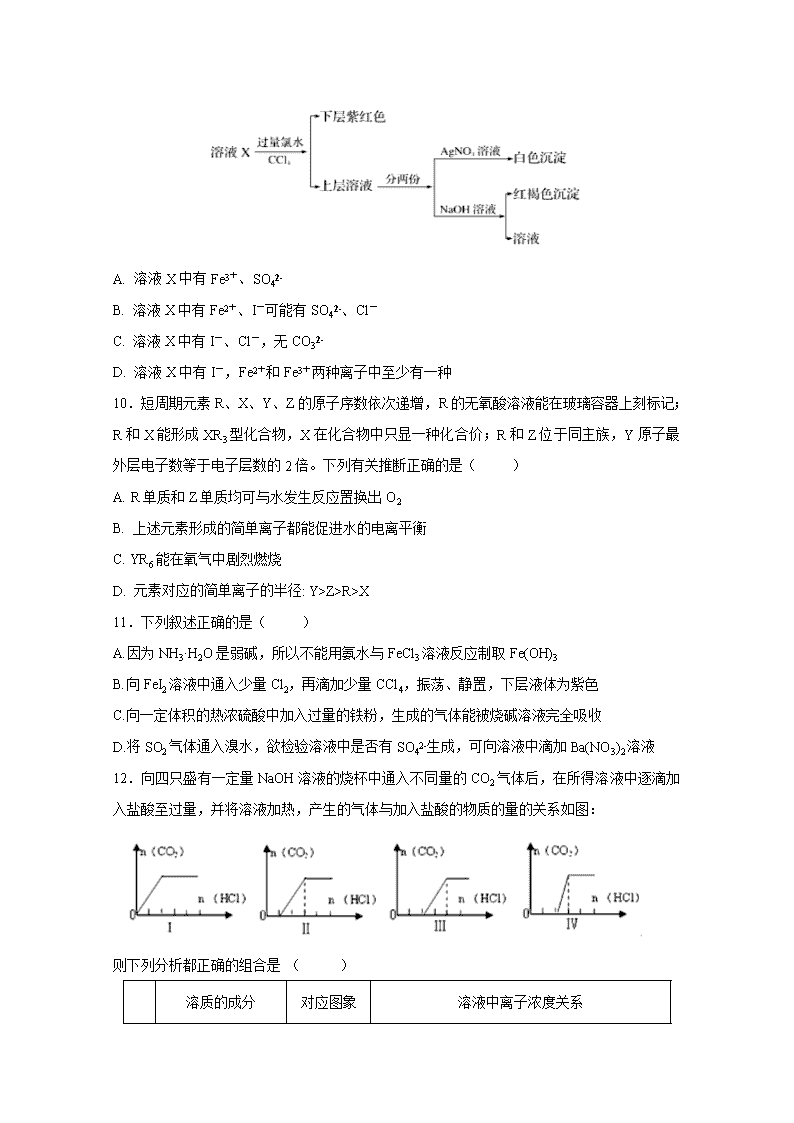
9.某溶液中可能含有K+、Na+、Fe3+、Fe2+、SO42-、CO32-、I-、Cl-中的一种或多种,进行如图所示的实验,下列说法正确的是( )
A. 溶液X中有Fe3+、SO42-
B. 溶液X中有Fe2+、I-可能有SO42-、Cl-
C. 溶液X中有I-、Cl-,无CO32-
D. 溶液X中有I-,Fe2+和Fe3+两种离子中至少有一种
10.短周期元素R、X、Y、Z的原子序数依次递增,R的无氧酸溶液能在玻璃容器上刻标记;R和X能形成XR3型化合物,X在化合物中只显一种化合价;R和Z位于同主族,Y原子最外层电子数等于电子层数的2倍。下列有关推断正确的是( )
A. R单质和Z单质均可与水发生反应置换出O2
B. 上述元素形成的简单离子都能促进水的电离平衡
C. YR6能在氧气中剧烈燃烧
D. 元素对应的简单离子的半径: Y>Z>R>X
11.下列叙述正确的是( )
A.因为NH3·H2O是弱碱,所以不能用氨水与FeCl3溶液反应制取Fe(OH)3
B.向FeI2溶液中通入少量Cl2,再滴加少量CCl4,振荡、静置,下层液体为紫色
C.向一定体积的热浓硫酸中加入过量的铁粉,生成的气体能被烧碱溶液完全吸收
D.将SO2气体通入溴水,欲检验溶液中是否有SO42-生成,可向溶液中滴加Ba(NO3)2溶液
12.向四只盛有一定量NaOH溶液的烧杯中通入不同量的CO2气体后,在所得溶液中逐滴加入盐酸至过量,并将溶液加热,产生的气体与加入盐酸的物质的量的关系如图:
则下列分析都正确的组合是 ( )
溶质的成分
对应图象
溶液中离子浓度关系
A
NaHCO3、Na2CO3
Ⅱ
c(CO32-)
c(CO32-)
C
Na2CO3
Ⅳ
c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
D
NaHCO3
I
c(Na+)=c(HCO3-)
A. A B. B C. C D. D
13.下列各组离子在指定溶液中一定能大量共存的是( )
①pH = 0的溶液:Na+、C2O42—、MnO4—、SO42—
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
③水电离的H+浓度为10-12mol·L-1的溶液中:Cl-、CO32-、NO3-、NH4+、SO32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-
⑤使石蕊变红的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42-
⑥中性溶液中:Fe3+、Al3+、NO3-、I-、Cl-、S2-
A.①②⑤ B.①③⑥ C.②④ D.①②④
14.通过实验、观察、类比、推理等方法得出正确的结论是化学学习的方法之一。下列实验操作、现象和解释或结论不正确的有( )
序号
实验操作
实验现象
解释或结论
①
用大理石和稀硝酸反应制取CO2气体,将制得的气体立即通入一定浓度的Na2SiO3溶液中
出现白色沉淀
H2CO3的酸性比H2SiO3的酸性强
②
向某溶液中加入浓NaOH溶液后微热,用蓝色石蕊试纸检验产生的气体
放出刺激性气味气体且试纸变红
原溶液中一定含有NH4+
③
少量铝热剂(只有一种金属氧化物)溶于足量稀盐酸后,分两份,再分别滴加铁氰化钾和KSCN溶液
出现蓝色沉淀和血红色
铝热剂中可能含有Fe3O4
④
向某钾盐中滴加浓盐酸,产生的气体再通入品红溶液
品红溶液褪色
该钾盐为K2SO3与KHSO3至少有一种
⑤
用pH试纸测量饱和新制氯水的pH
pH试纸先变为红色后褪色
饱和新制氯水呈酸性且Cl2具有漂白性
A. ①②④⑤ B. ②③④⑤ C. ①②④ D. ①②③⑤
15.在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是( )
A. 在含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:AlO2-、OH-、CO32-
B. 在含等物质的量的FeBr2、Fel2的溶液中,缓慢通入氯气:I-、Br-、Fe2+
C. 在含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+
D. 在含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:
KOH、Ba(OH)2、K2CO3、BaCO3
16.已知K2Cr2O7溶液中存在如下平衡:Cr2O7 2-(橙色)+ H2O2H++ 2CrO42- (黄色)。
①向2mL 0.1mol·L K2Cr2O7溶液中滴入3滴6mol/L NaOH溶液,溶液由橙色变为黄色;向所得溶液中再滴入5滴浓H2SO4,溶液由黄色变为橙色;
②向酸化K2Cr2O7溶液中滴入适量Na2SO3溶液,溶液由橙色变为绿色:
Cr2O72- + 8H++ 3SO32-=2Cr3+(绿色) + 3SO42- + 4H2O
下列分析正确的是( )
A.CrO42-和S2-在酸性溶液中可大量共存
B.实验②说明氧化性:Cr2O72->SO42-
C.稀释K2Cr2O7溶液时,溶液中各离子浓度均减小
D.实验①和②均能证明K2Cr2O7溶液中存在上述平衡
17.下列说法正确的是( )
A. FeCl3溶液可用于铜质印刷线路板的制作,该反应是置换反应
B. 向纯碱溶液中滴加醋酸,将生成的气体通入澄清的苯酚钠溶液中,观察是否出现沉淀,由此证明醋酸、碳酸、苯酚酸性强弱
C. 反应A(g)B(g); △H,若正反应的活化能为EakJ/mol,逆反应的活化能为EbkJ/mol,则△H=-(Ea-Eb)kJ/mol
D.
3x%的A物质的溶液与x%的A物质的溶液等体积混合后,溶液的质量分数小于2x%,则A物质可能为乙醇
18.实验室探究SO2与Fe(NO3)3溶液反应的原理,装置如下图,实验中Y装置产生白色沉淀。下列说法不正确的是( )
A. 滴加浓硫酸之前应进行的操作是打开弹簧夹,通入一段时间N2
B. Y中产生的白色沉淀是BaSO4或BaSO3
C. 产生白色沉淀的原因可能是在酸性条件下SO2与NO3- 反应生成了SO42-
D. 若将Fe(NO3)3换成FeCl3,Y中也能产生白色沉淀,说明Fe3+也能将SO2氧化
19.一定量的铁、镁和铜的混合物与一定量的浓HNO3恰好反应,得到硝酸盐溶液和NO2、N2O4、NO的混合气体,这些气体与2.24L O2(标准状况)混合后通入水中,所有气体恰好完全被水吸收生成硝酸.若向所得硝酸盐溶液中加入2mol/L的NaOH溶液至Fe3+、Mg2+、Cu2+恰好沉淀,则消耗NaOH 溶液的体积是( )
A. 400 mL B. 200 mL C. 150 mL D. 80 mL
20.将一定量的氯气通入30 mL浓度为10 mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是( )
A. 与NaOH反应的氯气一定为0.3 mol
B. n(Na+)∶n(Cl-)可能为7∶3
C. n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶2∶1
D. 若反应中转移的电子为n mol,则0.15<n<0.25
第II卷(非选择题,共60分)
二、非选择题
必做题:21、22、23
21. (14分)碳酸亚铁(白色固体,难溶于水)是一种重要的工业原料,可用于制备补血剂乳酸亚铁,也可用作可充电电池的电极。某研究小组通过下列实验,寻找利用复分解反应制备 FeCO3 沉淀的最佳方案:
实验
试剂
现象
滴管
试管
0.8 mol/L FeSO4 溶液(pH=4.5)
1 mol/L Na2CO3 溶液
(pH=11.9)
实验Ⅰ:立即产生灰绿色沉淀,5min 后出现明显的红褐色
0.8 mol/L FeSO4 溶液(pH=4.5)
1 mol/L NaHCO3 溶液
(pH=8.6)
实验Ⅱ:产生白色沉淀及少量无色气泡,2min 后出现明显的灰绿色
0.8 mol/L
(NH4)2Fe(SO4)2 溶液(pH=4.0)
1 mol/L NaHCO3 溶液
(pH=8.6)
实验Ⅲ:产生白色沉淀及无色气泡,较长时间保持白色
(1)实验 I 中红褐色沉淀产生的原因可用如下反应表示,请补全反应:
( ) Fe2+ +( ) +( ) +( ) H2O=( ) Fe(OH)3 ↓+( ) HCO3−
(2)实验 II 中产生 FeCO3 的离子方程式为_____________________________。
(3)为了探究实验 III 中 NH4+所起的作用,甲同学设计了实验 IV 进行探究:
操作
现象
实验IV
向 0.8 mol/L FeSO4 溶液中加入①__________,再加入 Na2SO4 固体配制成混合溶液(已知 Na+对实验无影响,忽略混合后溶液体积变化)。再取该溶液一滴管,与 2mL 1 mol/L NaHCO3 溶液混合
与实验 III 现象相同
实验 IV 中加入 Na2SO4 固体的目的是②_______________________。
对比实验 II、III、IV,甲同学得出结论:NH4+水解产生 H+,降低溶液 pH,减少了副产物 Fe(OH)2 的产生。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是:③_____________,再取该溶液一滴管,与 2mL 1 mol/L NaHCO3 溶液混合。
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验 III 中 FeCO3 的纯度最高,需要利用如图所示的装置进行定量测定。分别将实验 I、II、III 中的沉淀进行过滤、洗涤、干燥后称量,然后转移至 A 处的广口瓶中。
N2
碱石灰
浓硫酸
碱石灰
稀硫酸
为测定 FeCO3 的纯度,除样品总质量外,还需测定的物理量是______________________。
(5)实验反思:经测定,实验 III 中的 FeCO3 纯度高于方案 I 和方案 II。通过以上实验分析,制备 FeCO3 实验成功的关键因素是__________________________________。
22.(16分)根据下列有关天然气的研究和应用回答问题:
(l)在一定温度和压强下,由最稳定单质生成lmol化合物的焓变称为该物质的摩尔生成焓。根据此定义,稳定单质的摩尔生成焓为0,某些化合物的摩尔生成焓如下表所示:
化合物
CO2
CH4
CO
摩尔生成焓(kJ·mol-1)
-395
-74.9
-110.4
CH4(g)与CO2(g)反应生成CO(g)和H2(g)的热化学方程式为______________________。
(2)若上述反应分Ⅰ、Ⅱ两步进行,其能量曲线如图所示。则总反应的反应速率取决于反应_______(填“I”或“Ⅱ”)。
(3)一定温度下反应:CO2(g)+CH4(g) 2CO(g)+2H2(g)的平衡常数表达式Kp= __________(用平衡分压p(B)代替平衡浓度c(B)表示)。
(4)在压强为P1、P2、P3的三个恒压密闭容器中分别通入1.0molCH4(g)与1.0mol CO2(g ), 发生反应:CO2(g)+CH4(g) 2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图所示。
① a点时CH4的转化率为______________。
② 压强P1、P2、P3由大到小的顺序为_____________,判断理由是____________________。温度为Tl℃、压强为P3时,b点处v(正) ________v(逆)(填“<”、“>”或“="”)。
(5)某种燃料电池以熔融碳酸钠、碳酸钾为电解质,其工作原理如图所示,该电池负极的电极反应式为____________________________。若电极B附近通入1m3空气(假设空气中O2的体积分数为20% )并完全反应,理论上可消耗相同条件下CH4的体积为_______m3。
23.(14分)硫酸锌被广泛应用于医药领域和工农业生产。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4•7H2O的一种流程如图:
(1)步骤Ⅰ的操作是____________。
(2)步骤Ⅰ加入稀硫酸进行酸浸时,需不断通入高温水蒸气的目的是______________。
(3)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为____________________________________________。
(4)步骤Ⅲ中,加入锌粉的作用是______________。
(5)已知硫酸锌的溶解度与温度之间的关系如下表:
温度/℃
0
20
40
60
80
100
溶解度/g
41.8
54.1
70.4
74.8
67.2
60.5
从硫酸锌溶液中获得硫酸锌晶体的实验操作为________________、冷却结晶、过滤。烘干操作需在减压低温条件下进行,原因是_________________________________。
(6)取28.70 g ZnSO4•7H2O加热至不同温度,剩余固体的质量变化如图所示。分析数据,680℃时所得固体的化学式为______。
B(250℃,16.10g)
D(930℃, 8.10g)
C(680℃,13.43g)
A(100℃,17.90g)
a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4•H2O
选做题:24、25两小题任选一题做答。
24.( 16分)乙酰基扁桃酰氯是一种医药中间体。 某研究小组以甲苯和乙醇为主要原料,按下列路线合成乙酰基扁桃酰氯。
乙酰基扁桃酰氯
已知:
(1)甲苯与氯气反应生成 A的条件是________。
(2)物质 B中含有的官能团是________。
(3)物质 D 的结构简式是_________。
(4)下列说法正确的是________。
a.化合物 A不能发生取代反应
b.乙酰基扁桃酰氯属于芳香烃
c.化合物 C 能与新制的 Cu(OH)2发生反应
(5)E+F→G 的化学方程式是 。
(6)化合物 D 有多种同分异构体,同时符合下列条件的同分异构体共有_______ 种,写
出其中两种的同分异构体的结构简式_______。
①红外光谱检测表明分子中含有氰基(-CN);
②1H-NMR 谱检测表明分子中有苯环,且苯环上有两种不同化学环境的氢原子。
(7)设计以乙醇为原料制备 F 的合成路线(用流程图表示;无机试剂任选) _______。
25.(16分)钛镍形状记忆合金(TiNi)被广泛用于人造卫星和宇宙飞船的天线,在临床医疗领域内也具有广泛的应用。回答下列问题:
(1)写出基态Ti原子的电子排布式:_________,Ni在元素周期表中的位置是_________。
(2)钛镍合金能溶于热的硫酸生成Ti(SO4)2、NiSO4,二者阴离子的立体构型为______,中心原子的轨道杂化类型是_______。
(3)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是 ;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3
溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 。
(4)一种钛镍合金的立方晶胞结构如图所示:
Ti
Ni
①该合金中Ti的配位数为________。
②若合金的密度为d g/cm3,晶胞边长a=________pm。(用含d的计算式表示)
2017~2018学年度第二学期期末考试
高二化学答题纸
必做题:21、22、23
21.(14分)
(1) ( ) Fe2+ +( ) +( ) +( ) H2O=( ) Fe(OH)3↓+( ) HCO3−
(2)
(3)①
②
③
(4)
(5)
22.(16分)
(l)
(2)
(3)
(4)①
②
(5)
23.(14分)
(1)____________
(2)
(3)
(4)
(5)
(6)______
选做题:24、25两小题任选一题做答。
24.( 16分)
(1)________
(2)________
(3)_________
(4)________
(5)
(6)_______ _______
(7)
25.(16分)
(1)
(2)
(3)
(4)① ②
2017~2018学年度第二学期期末考试
高二化学参考答案
一、选择题(每小题2分,共40分)
题号
1
2
3
4
5
6
7
8
9
10
答案
C
C
A
D
A
D
B
B
B
D
题号
11
12
13
14
15
16
17
18
19
20
答案
B
A
C
A
C
B
D
B
B
D
二、非选择题(4小题,共60分)
必做题:
21. (14分)(1)4Fe 2+ + 8CO32− +1 O2 + 10H2O= 4Fe(OH) 3 + 8HCO3−
(2)Fe2+ + 2HCO3− =FeCO3↓+ CO2↑+ H2O
(3)①硫酸至 pH=4.0 ②控制 SO42- 浓度一致 ③向0.8mol/L FeSO4溶液中加入 Na2SO4 固体至 c(SO42-)=1.6 mol/L
(4) C 中 U 形管的增重
(5) 调节溶液 pH (每空2分)
22.(16分)(1) CH4(g)+CO2(g)2CO(g)+2H2(g) ΔH=+249.1kJ/mol
(2)I (1分)
(3)
(4)① 80% ②P3>P2>P1 该反应为气体分子数增大的反应,压强增大,平衡逆移,甲烷的体积分数增大 >(1分)
(5)CH4+4CO32--8e-=5CO2+2H2O 0.1 (除标注以外,其余每空各2分)
23. (14分)(1)过滤 (2)升高温度、使反应物充分混合,以加快反应速率
(3)3Fe2++MnO4-+8H2O=3Fe(OH)3↓+MnO(OH)2↓+5H+
(4)除去Cu2+
(5) 60℃条件下蒸发浓缩 降低烘干的温度,防止ZnSO4•7H2O分解
(6) b (每空2分)
选做题:
24. (16分)(1)光照 (2) 羟基或—OH (3) (4) c
(5)
(6)4
(7) CH3CH2OH CH3CHO CH3COOH CH3COCl(每空2分)
25. (16分)(1) 1s22s22p63s23d24s2或[Ar] 3d24s2 第4周期第VIII族
(2)正四面体 sp3
(3)产生白色沉淀;[Co (NH3)5SO4]Br
3
(4) 6 (每空2分)