- 2021-07-02 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
江西省上高二中2021届高三化学上学期第三次月考试题(Word版含答案)
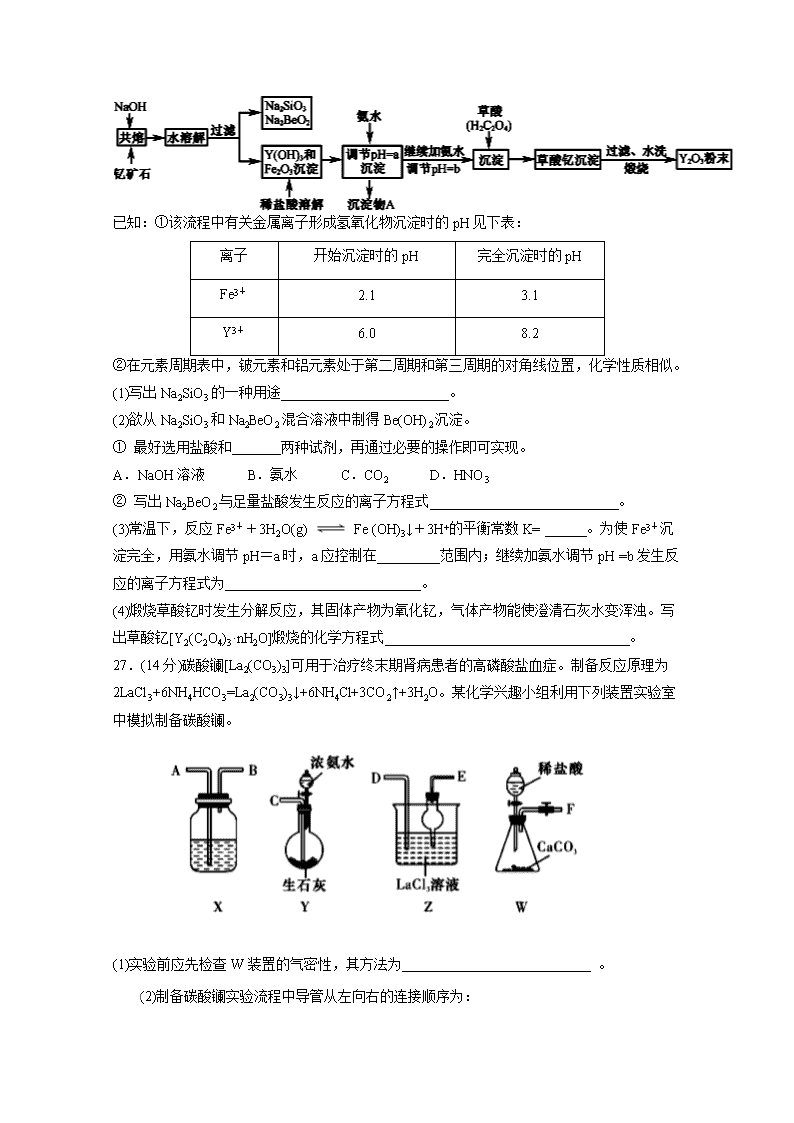
2021届高三年级第三次月考理科综合 7、化学与生产、生活、材料等密切相关, 下列叙述正确的是( ) A.“客从南溟来,遗我泉客珠。”“珍珠”的主要成分属于有机高分子化合物 B.“司南之杓(勺),投之于地,其柢(柄)指南”。司南中”杓”所用材质Fe2O3 C. 消毒酒精为质量分数75%的酒精溶液,能使蛋白质失去生理活性,喷洒消毒时要注意防火 D.制造口罩的熔喷布的主要成分是聚丙烯,聚丙烯是有机高分子化合物,属于混合物 8.医用酒精和84消毒液混合使用可能发生反应:4NaClO+CH3CH2OHHCCl3+HCOONa+NaCl+2NaOH+H2O,设NA为阿伏加德罗常数,下列叙述正确的是 ( ) A.含NA个ClO-的NaClO溶液中,Na+数目为NA B.100g质量分数为46%的乙醇溶液中所含的氢原子数为6NA C.上述反应中,每生成1molNaCl,转移的电子数为8NA D.标准状况下,2.24 L HCCl3含有的共用电子对的数目为0.4NA 9.下列离子方程式书写正确的是( ) A.热的纯碱溶液可以清洗油污的原因: B.明矾溶液中滴入Ba(OH)2溶液使SO42−恰好完全沉淀: 2Ba2++3OH-+Al3++2SO42−=2BaSO4↓+Al(OH)3↓ C.向NaHCO3溶液中加入过量的Ba(OH)2溶液: 2HCO+Ba2++2OH-===BaCO3↓+2H2O+CO D.1mol•L﹣1的NaAlO2溶液和2.5mol•L﹣1的HCl溶液等体积互相均匀混合: 2AlO2﹣+5H+=Al3++Al(OH)3↓+H2O 10.化合物1,1二环丙基乙烯是重要的医药中间体。下列有关该化合物的说法正确的是( ) A.分子中所有碳原子共平面 B.其同分异构体可能是苯的同系物 C、可以发生加成反应、氧化反应和加聚反应 D.一氯代物有4种 11.下列依据实验操作及现象得出的结论正确的是( ) 12. 废气的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体慢慢通入FeC13、FeC12、CuC12的混合溶液中反应回收S,其物质转化如图所示。下列叙述正确的是 A.由图示的转化可得出氧化性的强弱顺序:O2 >Fe3+> S B.在转化过程中能循环利用的物质只有FeCl2 C.在转化过程中化合价不变的元素只有Cu和Cl D.反应中当有34g H2S转化为硫单质时,保持溶液中Fe3+的量不变,需要消耗O2 11.2 L 13.实验室模拟氨催化氧化法制硝酸的装置如图所示(无水CaCl2可用于吸收氨气),下列说法正确的是( ) A.装置①、②、⑤依次盛装碱石灰、无水CaCl2、浓硫酸 B.装置③中气体呈红棕色 C.装置④中溶液可使无色酚酞溶液变红 D.通空气的主要作用是鼓出氨气,空气可用N2代替 26.(14分)钇的常见化合价为+3价,我国蕴藏着丰富的含钇矿石(Y2FeBe2Si2O10),工业上通过如下生产流程可获得氧化钇。 已知:①该流程中有关金属离子形成氢氧化物沉淀时的pH见下表: 离子 开始沉淀时的pH 完全沉淀时的pH Fe3+ 2.1 3.1 Y3+ 6.0 8.2 ②在元素周期表中,铍元素和铝元素处于第二周期和第三周期的对角线位置,化学性质相似。 (1)写出Na2SiO3的一种用途________________________。 (2)欲从Na2SiO3和Na2BeO2混合溶液中制得Be(OH)2沉淀。 ① 最好选用盐酸和_______两种试剂,再通过必要的操作即可实现。 A.NaOH溶液 B.氨水 C.CO2 D.HNO3 ② 写出Na2BeO2与足量盐酸发生反应的离子方程式___________________________。 (3)常温下,反应Fe3++3H2O(g) Fe (OH)3↓+3H+的平衡常数K= ______。为使Fe3+沉淀完全,用氨水调节pH=a时,a应控制在_________范围内;继续加氨水调节pH =b发生反应的离子方程式为____________________________。 (4)煅烧草酸钇时发生分解反应,其固体产物为氧化钇,气体产物能使澄清石灰水变浑浊。写出草酸钇[Y2(C2O4)3·nH2O]煅烧的化学方程式___________________________________。 27.(14分)碳酸镧[La2(CO3)3]可用于治疗终末期肾病患者的高磷酸盐血症。制备反应原理为2LaCl3+6NH4HCO3=La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O。某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。 (1)实验前应先检查W装置的气密性,其方法为___________________________ 。 (2)制备碳酸镧实验流程中导管从左向右的连接顺序为: →____→____→____→____→____。 (3)Y中发生反应的化学反应方程式为___________________________。 (4)Z中应先后通入两种气体其原因为___________________________。 (5)La2(CO3)3质量分数的测定:准确称取10.0g产品试样,溶于10.0ml.稀盐酸中,加入10mLNH3—NH4Cl缓冲溶液,加入0.2g紫脲酸铵混合指示剂,用0.5mol/LEDTA(Na2H2Y)标准溶液滴定至呈蓝紫色(La3++H2Y2-=LaY-+2H+),消耗EDTA溶液44.0ml。则产品中La2(CO3)3的质量分数ω[La2(CO3)3]= ____。 (6)该化学兴趣小组根据已学Na2CO3、NaHCO3的性质,设计实验探究La2(CO3)3和La(HCO3)3的稳定性强弱,设计了如下的实验装置,则甲试管中盛放的物质为____;实验过程中,发现乙试管中固体质量与灼烧时间的关系曲线如图所示,试描述实验过程中观察到的现象为___________________________。 28.(15分)三氧化钼(MoO3)是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿(主要成分为MoS2)通过一定条件来制备。回答下列相关问题: (1)已知: ①MoS2(s)Mo(s)+S2(g) H1 ②S2(g)+2O2(g)2SO2(g) H2 ③2Mo(s)+3O2(g)2MoO3(s) H3 则2MoS2(s)+7O2(g)2MoO3(s)+4SO2(g)的H= (用含H1、H2、H3的代数式表示)。 (2)若在恒温恒容条件下,仅发生反应MoS2(s)Mo(s)+S2(g) ①下列说法不正确的是___(填字母)。 A.气体的密度不变,则反应一定达到了平衡状态 B.气体的相对分子质量不变,反应一定处于平衡状态 C.增加MoS2的量,平衡正向移动 ②达到平衡时S2(g)的浓度为1.4mol•L-1,充入一定量的S2(g),反应再次达到平衡,S2(g)浓度____(填“>”“<”或“=”)1.4mol•L-1。 (3)在2L恒容密闭容器中充入1.0molS2(g)和1.5molO2(g),若仅发生反应:S2(g)+2O2(g)2SO2(g),5min后反应达到平衡,此时容器压强为起始时的80%,则0~5min 内,S2(g)的反应速率为____mol•L-1•min-1。 (4)在恒容密闭容器中,加入足量的MoS2和O2,仅发生反应:2MoS2(s)+7O2(g)2MoO3(s)+4SO2(g) H。测得氧气的平衡转化率与起始压强、温度的关系如图所示。 ①△H____(填“<”“>”或“=”)0;比较p1、p2、p3的大小: 。 ②若初始时通入7.0molO2,P2为7.0kPa,则A点平衡常数Kp= (用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,写出计算式即可)。压强为p1,温度为1100K时,平衡常数Kp′ (填“>”“<”或“=”)Kp。 36. [化学—选修5:有机化学基础](15分) 有机物H是一种药物的主要成分,工业上的合成路线如图所示(部分试剂和反应条件已略去): 已知: Ⅰ. Ⅱ.(易被氧化) 回答下列问题: (1)B的结构简式是____________,F中官能团的名称是____________。 (2)反应②需加入的试剂及反应条件为 ________。 (3)E与足量NaOH溶液反应的化学方程式是____________________________ _____________________________。 (4)C[C7H8O]的同分异构体有________种,其中符合下列条件且核磁共振氢谱中有四组峰的结构简式为__________________________。 ①分子中含有苯环 ②能与Na反应放出H2。 (5)已知苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时 则取代在间位。据此写出以A为原料合成的合成路线 ______________________________________。 2021届高三年级第三次月考理科综合答案 第三次月考化学部分答案 7-13 D C D C B A B 26.(14分)【每空2分】 (1) 工业粘合剂、制备硅胶、木材防火剂等 (2) ①B ② BeO22-+4H+===Be2++2H2O (3) 10-4.3 3.1~6.0 Y3++3NH3·H2O=Y(OH)3↓+3NH4+ (4) Y2(C2O4)3·nH2OY2O3+3CO↑+3CO2↑+nH2O 27.(14分)【每空2分】 (1) 关闭止水夹,打开分液漏斗阀门,向锥形瓶中加水直至分液漏斗内液面高出锥形瓶内液面,若一段时间之后,分液漏斗中液面不下降,则证明该装置气密性完好 (2) ABDEC (3) NH3·H2O+CaO=Ca(OH)2+NH3↑ (4) NH3在水的溶解度大,创造碱性环境,有利于CO2溶解 (5) 50.38% (6) La(HCO3)3 A、B中溶液都变浑浊 28.(15分)【除标注外,其余每空2分】 (1) H=2H1+2H2+H3 (2) ① BC ② = (3) 0.05 mol•L-1•min-1 (单位已给,不带也得分) (4) ① < P1>P2>P3 ② > (1分) 36. (15分,除特殊标记外,其余每空2分) (1) 羧基和(酚)羟基 (2) 浓硫酸和浓硝酸,加热 (3) +3NaOH+CH3COONa+2H2O (4) 4 (5) (3分)查看更多