- 2021-07-02 发布 |
- 37.5 KB |
- 10页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
高考化学第一轮复习课时知能训练8
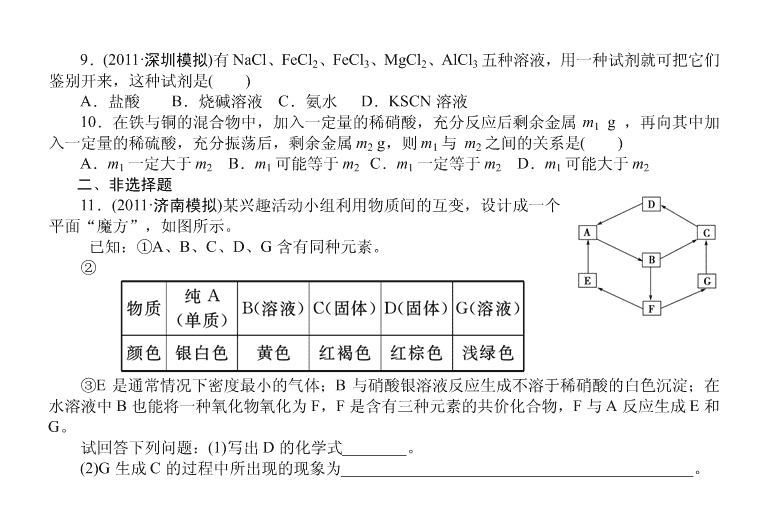
一、选择题 1.我国科学家参与研制的阿尔法磁谱仪已随美国发现号航天飞船升入太空,开始了探索宇 宙中是否存在“反物质”的研究工作。根据你所学的知识推测用于制造阿尔法磁谱仪的核心部件 的材料是( ) A.FeO B.Fe2O3 C.Fe3O4 D.Fe(OH)3 2.(原创题)常温下把铁片投入下列溶液中充分反应,铁片质量增加的是( ) A.FeCl3 B.CuSO4 C.AlCl3 D.浓 HNO3 3.如图 M、N 为含 X 元素的常见化合物。则 X 元素为( ) A.Fe B.Zn C.Cu D.Al 4.(2011·泰安模拟)向含有 FeCl3 和 BaCl2 的酸性溶液中通入足量的 SO2,有白色沉淀生成, 过滤后向滤液中滴入 KSCN 溶液时,无明显现象,由此得出的正确结论是( ) A.白色沉淀是 FeSO3 B.白色沉淀是 BaSO3 和 BaSO4 的混合物 C.白色沉淀是 BaSO4 D.FeCl3 已全部被 SO2 氧化成 FeCl2 5.(改编题)孔雀石主要含有 Cu2(OH)2CO3,还含有少量 Fe 和 Si 的氧化物,实验室以孔雀石 为原料制备纯净 CuSO4·5H2O,步骤如下: 则试剂①和试剂②最好是( ) A.KMnO4 和 NaOH B.H2O2 和 CuO C.氯水和 Cu(OH)2 D.KMnO4 和 Cu 6.(2011·聊城模拟)向一定量的 Fe、FeO、Fe2O3 的混合物中,加入 100 mL 1 mol/L 的盐酸, 恰好使混合物完全溶解,放出 224 mL(标准状况)气体,所得溶液加 KSCN 溶液无红色出现,那么 若用足量的 CO 在高温下还原相同质量的混合物,能得到铁( ) A.11.2 g B.2.8 g C.5.6 g D.无法计算 7.向一定量的 Cu、Fe2O3 的混合物中加入 300 mL 1 mol·L-1 的 HCl 溶液,恰好使混合物完全 溶解,所得溶液中加入 KSCN 溶液后无红色出现,若用过量的 CO 在高温下还原相同质量的此混 合物,则固体的质量减少了( ) A.6.4 g B.4.8 g C.2.4 g D.1.6 g 8.取 100 mL 0.2 mol/L FeCl3 溶液置于烧杯中,向其中加入一定量的 Fe、Cu 混合物,充分反 应后仍有固体剩余,下列叙述一定正确的是(设溶液体积不变,不考虑水解因素)( ) A.烧杯中有 Fe 无 Cu,c(Fe2+)=0.2 mol/L B.烧杯中有 Cu 无 Fe,c(Fe2+)=0.3 mol/L C.烧杯中有 Cu 无 Fe,c(Cl-)=0.2 mol/L D.烧杯中 Fe、Cu 均有,c(Fe2+)=0.3 mol/L 9.(2011·深圳模拟)有 NaCl、FeCl2、FeCl3、MgCl2、AlCl3 五种溶液,用一种试剂就可把它们 鉴别开来,这种试剂是( ) A.盐酸 B.烧碱溶液 C.氨水 D.KSCN 溶液 10.在铁与铜的混合物中,加入一定量的稀硝酸,充分反应后剩余金属 m1 g ,再向其中加 入一定量的稀硫酸,充分振荡后,剩余金属 m2 g,则 m1 与 m2 之间的关系是( ) A.m1 一定大于 m2 B.m1 可能等于 m2 C.m1 一定等于 m2 D.m1 可能大于 m2 二、非选择题 11.(2011·济南模拟)某兴趣活动小组利用物质间的互变,设计成一个 平面“魔方”,如图所示。 已知:①A、B、C、D、G 含有同种元素。 ② ③E 是通常情况下密度最小的气体;B 与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀;在 水溶液中 B 也能将一种氧化物氧化为 F,F 是含有三种元素的共价化合物,F 与 A 反应生成 E 和 G。 试回答下列问题:(1)写出 D 的化学式________。 (2)G 生成 C 的过程中所出现的现象为____________________________________________。 (3)写出下列反应的化学方程式:E→A___________;A→B____________________________。 (4)B→F 的离子方程式为_____________________; G 与 Cl2 反应的离子方程式为________________________________________________。 12.(改编题)运用铁及其化合物的知识,完成下列各题。 (1)下列物质跟铁反应后的生成物,能跟 KSCN 溶液作用生成红色溶液的是__________。 A.盐酸 B.氯气 C.CuSO4 溶液 D.稀硫酸 (2)用饱和 FeCl3 溶液制备 Fe(OH)3 胶体的离子方程式为 ________________________________________________________________________。 (3)证明 Fe3O4 中含有+2 价铁的方法(写出操作步骤,现象和结论)_____________________。 (4)天然食品中含有的大多是+3 价铁,为了使+3 价铁转化为+2 价铁并被人体较好地吸收, 你认为应该采取的措施是__________________________。 13.(2010· 组合题)(1)在一定量的稀 HNO3 中慢慢加入铁粉,得到的 Fe2+的物质的量(纵坐标) 与所加铁粉的物质的量(横坐标)的关系如图所示。请将正确答案的字母填在相应的横线上。 ①AB 段铁元素以________形式存在。②BC 段铁元素以________形式存在。 ③CD 段铁元素以________形式存在。 (2)将 Cu、Fe、FeCl3 溶液和 CuCl2 溶液混合于某容器中充分反应(容器不参与反应),试判断 下列情况下容器中存在的金属离子和金属单质。 ①若 Fe 有剩余,则容器中不可能有________。 ②若 CuCl2 有剩余,则容器中还可能有________,一定有________。 14.(2010·四川高考有删减)四川攀枝花蕴藏丰富的钒、钛、铁资源。用钛铁矿渣(主要成分为 TiO2、FeO、Fe2O3,Ti 的最高化合价为+4)为原料,生产白色颜料二氧化钛的主要步骤如下: 请回答下列问题: (1)硫酸与二氧化钛反应的化学方程式是______________________。 (2)向滤液Ⅰ中加入铁粉,发生反应的离子方程式为____________。 (3)A 可用于生产红色颜料(Fe2O3),其方法是:将 556a kg A(摩尔质量为 278 g/mol)溶于水中, 加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐色胶体中 加入 3 336b kg A 和 112c kg 铁粉,鼓入足量空气搅拌,反应完成后,有大量 Fe2O3 附着在胶体粒 子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫 酸铁,则理论上可生产红色颜料________kg。 答案及解析 1.【解析】 核心部件的材料应具有磁性,应该为 Fe3O4。【答案】 C 2.【解析】 本题考查 Fe 的主要性质。A 项铁溶解,铁片减轻,A 错;B 项 Fe 置换出 Cu, 固体增重,B 正确;Al 比 Fe 活泼,Fe 不反应,C 错。D 项浓 HNO3 常温下将铁片钝化,表面生 成氧化膜,质量增加,D 正确。【答案】 BD 3.【解析】 由题意知 X 为变价元素。【答案】 A 4.【解析】 FeCl3 和 SO2 分别具有氧化性和还原性,发生 2Fe3++SO2+2H2O===SO2- 4 +2Fe2 ++4H+。Ba2++SO2- 4 ===BaSO4↓。 故白色沉淀为 BaSO4,则 C 项正确,A、B 项错误。FeCl3 被 SO2 还原成 FeCl2,则 D 项错误。 【答案】 C 5.【解析】 本题以化学工艺流程图为载体,设计化学方案制备化学物质。A 项两试剂均引 入杂质,C 项中氯水引入 Cl-,D 项 KMnO4 引入杂质,Cu 不能降低酸性,Fe3+不能生成 Fe(OH)3。 【答案】 B 6.【解析】 本题主要考查 Fe 及其化合物的性质,利用守恒法知,FeCl2~Fe~2HCl n(Fe)=1 2n(HCl)=0.1 L×1 mol/L×1 2=0.05 mol,m(Fe)=2.8 g。【答案】 B 7.【解析】 加入盐酸反应后产物为 CuCl2、FeCl2 和 H2O,故盐酸正好全部转化为 H2O,固 体质量减少的是氧,由 H2O 的组成可知 n(O)=n(H2O)=1 2n(HCl)=0.15 mol。则减少的质量为 0.15 mol×16 g/mol=2.4 g。【答案】 C 8.【解析】 阳离子的氧化性:Fe3+>Cu2+>Fe2+,单质的还原性:Fe>Cu。溶液中首先发 生反应 Fe+2Fe3+===3Fe2+。若 Fe3+有剩余,再发生 Cu+2Fe3+===Cu2++2Fe2+,故溶液中不可能 有 Fe 无 Cu;若有 Cu 无 Fe,则有 c(Fe2+)≤0.3 mol/L;若 Fe、Cu 均有,则说明 Cu 未参加反应, 则 c(Fe2+)=0.3 mol/L;Cl-不受反应的影响,故 c(Cl-)=0.6 mol/L,所以 D 项正确。【答案】 D 9.【解析】 将过量 NaOH 溶液分别加入上述几种溶液,无明显现象的是 NaCl,生成白色 沉淀且迅速变为灰绿色最后变为红褐色的是 FeCl2,直接生成红褐色沉淀的是 FeCl3,生成白色沉 淀不溶解的是 MgCl2,生成白色沉淀又溶解的是 AlCl3,而氨水虽然能区分出 NaCl、FeCl2、FeCl3, 但不能将 MgCl2 与 AlCl3 区分开。【答案】 B 10.【解析】 铁和铜的混合物与一定量的稀硝酸反应,当金属剩余时,硝酸耗尽。若再向 其中加入稀硫酸,则加入的 H+与溶液中的 NO- 3 又形成 HNO3,可能继续发生如下反应:3Cu+8H ++2NO- 3 ===3Cu2++2NO↑+4H2O 或 3Fe+8H++2NO- 3 ===3Fe2++2NO↑+4H2O,使剩余金属 的质量减少,所以 m1 一定大于 m2。【答案】 A 11.【解析】 由①②可知 A、B、C、D、G 都含 Fe 元素,结合表中的颜色可知 G 含 Fe2+, A 为铁单质,B 含 Fe3+,C 为 Fe(OH)3,D 为 Fe2O3。再由③可知 E 为 H2,B 为 FeCl3,因 F 是含 有三种元素的共价化合物,F 与 A 反应生成 E 和 G,又因为 F 是由 FeCl3 在水溶液中将一种氧化 物氧化得到的,可推知 F 为一种含氧酸,结合中学所学知识可推测此氧化物为具有还原性的 SO2, F 为 H2SO4。 【答案】 (1)Fe2O3 (2)先产生白色沉淀,白色沉淀迅速变为灰绿色,最后变为红褐色 (3)4H2+Fe3O4 3Fe+4H2O(g) 2Fe+3Cl2 2FeCl3 (4)2Fe3++SO2+2H2O===2Fe2++SO2- 4 +4H+ 2Fe2++Cl2===2Fe3++2Cl- 12.【解析】 本题主要考查铁及其化合物的基础知识。 (1)红色溶液说明生成物中含+3 价 Fe。(2)FeCl3 可以水解生成 Fe(OH)3。 (3)Fe3O4 中含+3 和+2 价,注意 Fe3+的干扰,要利用 Fe2+的还原性进行证明。 (4)可加入还原剂还原+3 价 Fe。【答案】 (1)B (2)Fe3++3H2O Fe(OH)3(胶体)+3H+ (3)取 Fe3O4 少许放入试管中,加入稀盐酸溶解完全,然后加入酸性 KMnO4 溶液,若紫色褪 去说明 Fe3O4 中含有+2 价铁 (4)加入 Fe 粉或加入其他还原剂 13.【解析】 (1)本题考查 Fe 与 HNO3 反应时产物与 Fe 的数量关系,Fe 过量生成 Fe(NO3)2, HNO3 过量生成 Fe(NO3)3。 (2)该问涉及的反应有:Fe+2FeCl3===3FeCl2,Fe+CuCl2===FeCl2+Cu,2FeCl3+Cu===2FeCl2 +CuCl2。若铁粉有剩余,则容器中不可能有 Fe3+、Cu2+,若 CuCl2 有剩余,则容器中不可能有 Fe,可能有 Fe3+或 Cu,一定有 Fe2+。 【答案】 (1)①a ②d ③c (2)①Fe3+、Cu2+ ②Fe3+或 Cu Fe2+ 14.【解析】 (1)由于 Ti 的化合价最高价为+4,与 H2SO4 反应为复分解反应,所以方程式 为 TiO2+2H2SO4===Ti(SO4)2+2H2O。 (2)滤液Ⅰ中含有 Fe3+可与铁粉反应,Fe+2Fe3+===3Fe2+,过量的 H2SO4 也可与 Fe 反应 Fe +2H+===Fe2++H2↑ (3)A 是 FeSO4·7H2O。 由 556a kg A 鼓入空气生成 Fe(OH)3 反应中与 NaOH 之间的关系是: FeSO4·7H2O~2NaOH~Na2SO4~1 2Fe2O3 ① 278 80 556a kg m1=160a kg 又由于最终溶液中只存在 Fe2(SO4)3 和 Na2SO4,以 Fe 和 SO2- 4 守恒得到关系式②③。 FeSO4·7H2O~1 3Fe2(SO4)3+1 6Fe2O3 ② 278 160 6 3 336b kg m2=320b kg Fe ~ 1 2Fe2O3 ③ 56 80 112c kg m3=160c kg 理论上可生成 Fe2O3 的质量为 m1+m2+m3=(160a+320b+160c) kg。 【答案】 (1)TiO2+2H2SO4===Ti(SO4)2+2H2O (2)Fe+2Fe3+===3Fe2+ Fe+2H+===Fe2++H2↑ (3)160a+320b+160c查看更多