- 2021-07-02 发布 |
- 37.5 KB |
- 6页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届二轮复习化学基本理论作业(全国通用)
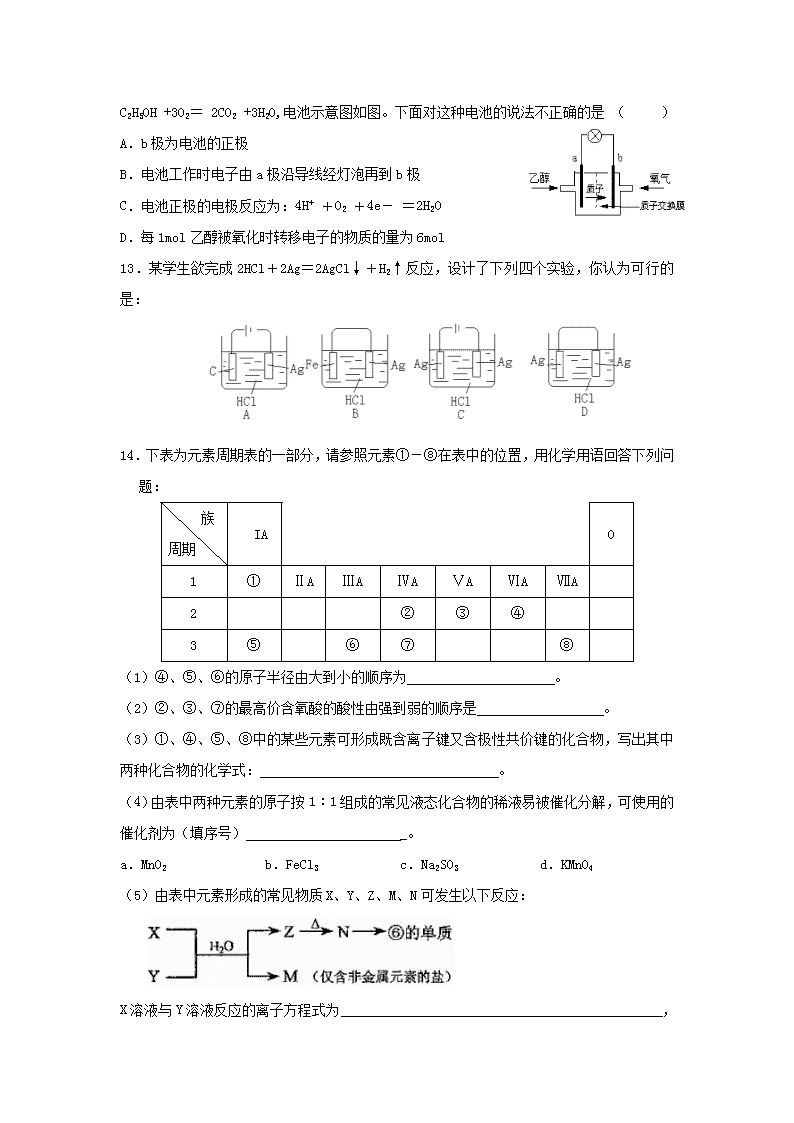
化学基本理论 .碘单质及其化合物具有重要应用。下列说法正确的是( ) A.与互为同位素 B.加碘食盐能使淀粉溶液变蓝 C.从海带中提取I2的过程只发生物理变化 D.I和Cl是同族元素,HI比HCl稳定 .W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7︰17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色。下列判断正确的是( ) A.金属性:Y>Z B.氢化物的沸点:X>W C.离子的还原性:X>W D.原子及离子半径:Z>Y>X .元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是( ) A.同周期元素中X的金属性最强 B.原子半径X>Y,离子半径X+>Z2- C.同族元素中Z的氢化物稳定性最高 D.同周期元素中Y的最高价含氧酸的酸性最强 4. 25℃时,a mol·L-1一元酸HA与b mol·L-1NaOH等体积混合后,pH为7,则下列关系一定正确的是( ) A.a=b B.a>b C.c (A-)= c(Na+) D.c (A-)< c(Na+) 5.根据以下事实得出的判断一定正确的是( ) A.HA的酸性比HB的强,则HA溶液pH比HB溶液的小 B.A+和B-的电子层结构相同,则A原子的核电荷数比B原子的大 C.A盐的溶解度在同温下比B盐的大,则A盐溶液的溶质质量分数比B盐溶液的大 D.A原子失去的电子比B原子的多,则A单质的还原性比B单质的强 6.已知:H2(g)+I2(g)2HI(g);△H < 0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是( ) A.甲、乙提高相同温度 B.甲中加入0.1 mol He,乙不变 C.甲降低温度,乙不变 D.甲增加0.1 mol H2,乙增加0.1 mol I2 7.在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表: 物质 X Y Z 初始浓度/mol·L-1 0.1 0.2 0 平衡浓度/mol·L-1 0.05 0.05 0.1 下列说法错误的是:( ) A.反应达到平衡时,X的转化率为50% B.反应可表示为X+3Y2Z,其平衡常数为1600 C.增大压强使平衡向生成Z的方向移动,平衡常数增大 D.改变温度可以改变此反应的平衡常数 8.设1L pH=6的AlCl3溶液中,由水电离出的H+物质的量为n1;1L pH=6的HCl溶液中,由水电离出的H+物质的量为n2。则n1∕n2的值是 ( ) A.1 B.100 C.1000 D.10000 9.常温下,0.1 mol·L-1某一元酸(HA)溶液中 =1×10-8,下列正确的是( ) A.该溶液中由水电离出的c(H+)=1×10-3 mol·L-1 B.0.1mol/L的NaA溶液中的离子浓度大小关系为:c(Na+)>c(A-) >c(H+)>c(OH-) C.该溶液中水的离子积常数为1×10-22 D.用0.1 mol·L-1NaOH溶液V1 L 与0.1 mol·L-1该一元酸(HA)V2 L溶液混合,若混合溶液的pH = 7,则V1<V2 10.下列叙述中不正确的是 ( ) A.在0.1 mol/L CH3COOH溶液中,c(H+) = c(CH3COO-) + c(OH-) B.常温下将10 mL 0.02 mol/L NaOH溶液与10 mL 0.02 mol/L H2SO4溶液充分混合,若混合后溶液的体积为20 mL,则混合后溶液的pH=2 C.在0.1 mol/L Na2CO3溶液中,2c(Na+) = c(H2CO3)+c(CO32-)+c(HCO3-) D.在0.1 mol/L NH4Cl溶液中,c(H+) = c(NH3·H2O) + c(OH-) 11.有关X、Y、Z、W四种金属进行如下实验: 1 将X和Y用导线连接,浸入电解质溶液中,Y不易腐蚀 2 将片状的X、W分别投入等浓度盐酸中都有气体产生,W比X反应剧烈 3 用惰性电极电解等物质的量浓度的Y和Z的硝酸盐混合溶液,在阴极上首先析出单质Z 根据以下事实,下列判断或推测错误的是( ) A.Z的阳离子氧化性最强; B.W的还原性强于Y的还原性 C.Z放入CuSO4溶液中一定有Cu析出; D.用X、Z和稀硫酸可构成原电池,且X做负极 12.一种新型乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍。电池总反应为: C2H5OH +3O2= 2CO2 +3H2O,电池示意图如图。下面对这种电池的说法不正确的是 ( ) A.b极为电池的正极 B.电池工作时电子由a极沿导线经灯泡再到b极 C.电池正极的电极反应为:4H+ +O2 +4e- =2H2O D.每1mol乙醇被氧化时转移电子的物质的量为6mol 13.某学生欲完成2HCl+2Ag=2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的是: 14.下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题: 族 周期 IA 0 1 ① ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 2 ② ③ ④ 3 ⑤ ⑥ ⑦ ⑧ (1)④、⑤、⑥的原子半径由大到小的顺序为 。 (2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 。 (3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中两种化合物的化学式: 。 (4)由表中两种元素的原子按1︰1组成的常见液态化合物的稀液易被催化分解,可使用的催化剂为(填序号) _。 a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4 (5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应: X溶液与Y溶液反应的离子方程式为 , N→⑥的单质的化学方程式为 。 常温下,为使0.1 mol/L M 溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至 。 15.将lmol I2(g)和2mol H2置于某2L密闭容器中,在一定温度下发生反应: I2(g)+H2(g) 2HI(g);△H<0,并达平衡,HI的体积分数W(HI)随时间变化如图曲线(Ⅱ)所示 (1)达平衡时,I2(g)的物质的量浓度为 。 (2)若改变反应条件,在甲条件下w(HI)的变化如图曲线(Ⅰ)所示,在乙条件下W(HI)的变化如图曲线(Ⅲ)所示。则甲条件可能是 (填入下列条件的序号。下同),乙条件可能是 。 ①恒容条件下,升高温度 ②恒容条件下,降低温度 ③恒温条件下,缩小反应容器体积 ④恒温条件下,扩大反应容器体积 ⑤恒温恒容条件下,加入适当催化剂 (3)若保持温度不变,在另一相同的2L密闭容器中 加入amol I2(g)、bmol H2和cmol HI(a、b、c均大于0),发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是 。 16.(1)元素M的离子与NH4+所含电子数和质子数均相同,则M的原子结构示意图为 (2)硫酸铝溶液与过量氨水反应的离子方程式为 。(3)能证明Na2SO3溶液中存在SO32—+H2OHSO3—+OH—水解平衡的事实是 A. 滴入酚酞溶液变红,再加入H2SO4溶液红色退去 B. 滴入酚酞溶液变红,再加入氯水后红色退去 C. 滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色退去 (4)元素X、Y在周期表中位于同一主族,化合物Cu2X和Cu2Y可发生如下转化(其中D是纤维素水解的最终产物): ①非金属X Y(填“>”或“<”) ②Cu2Y与过量浓硝酸反应有红棕色气体生成,化学方程式为 。 (5)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)2C (g)+D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系: 。 物 质 A B C D 起始投料/mol 2 1 2 0 参考答案 1. A 2. B 3. B 4. C 5. B 6. C 7. C 8. B 9. D 10. C 11. C 12. D 13. C 14.(1)Na>Al>O (2)HNO3>H2CO3>H2SiO3 (3)NaOH,NaClO (4)a b (5)Al3++3NH3·H2O=Al(OH)3↓+3NH4+ 2Al2O3(熔融) 4Al+3O2↑ 溶液的pH等于7 15.(1) 0.05mol/L; (2) ③⑤; ④ (3) 2b-4a=c 16.解析:(1)铵根离子中含有10个电子,11个质子,与之相同的单核离子为钠离子,则M的原子结构示意图为 (2)硫酸铝溶液与过量氨水反应的离子方程式为:Al3++3NH3·H2O=Al(OH)3↓+3NH4+ (3)选C,ABC三个选项描述都是正确的,但要说明亚硫酸钠显碱性是亚硫酸离子水解造 成的,存在水解平衡这一事实。比如说向氢氧化钠这样的碱溶液中加入酚酞后变红,用AB 两项中的试剂都可褪色,但用C中的试剂就不行。选择试剂最好是中性,并与亚硫酸根离子 反应,使水解平衡移动,这样一比较C可以充分说明亚硫酸钠显碱性是亚硫酸离子水解造成 的。 (4)先推断元素,悬浊液与D的溶液(葡萄糖溶液)生成砖红色沉淀是氧化亚铜,则Y为O元素,X,Y同主族,则X为S元素。问题就很好回答,非金属性X<Y,Cu2O与浓硝酸反应生成红棕色的气体NO2,利用氧化还原反应原理并配平可写出方程式:Cu2O+6HNO3(浓)=2Cu(NO3)2+2NO2↑+3H2O (5)在恒容绝热的情况下,反应达到平衡后,体系压强升高,可推知气体体积变大,说明反应是向左移(注意D为固态)。另外压强与温度成正比,压强升高,温度升高,如果正反应是放热的情况下,则是升高温度,平衡向左移,符合题目情况。因此推出正反应是放热反应,那平衡常数与温度成反比。(不妥)查看更多