- 2021-07-02 发布 |
- 37.5 KB |
- 4页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高中化学 第三章 金属及其化合物 3
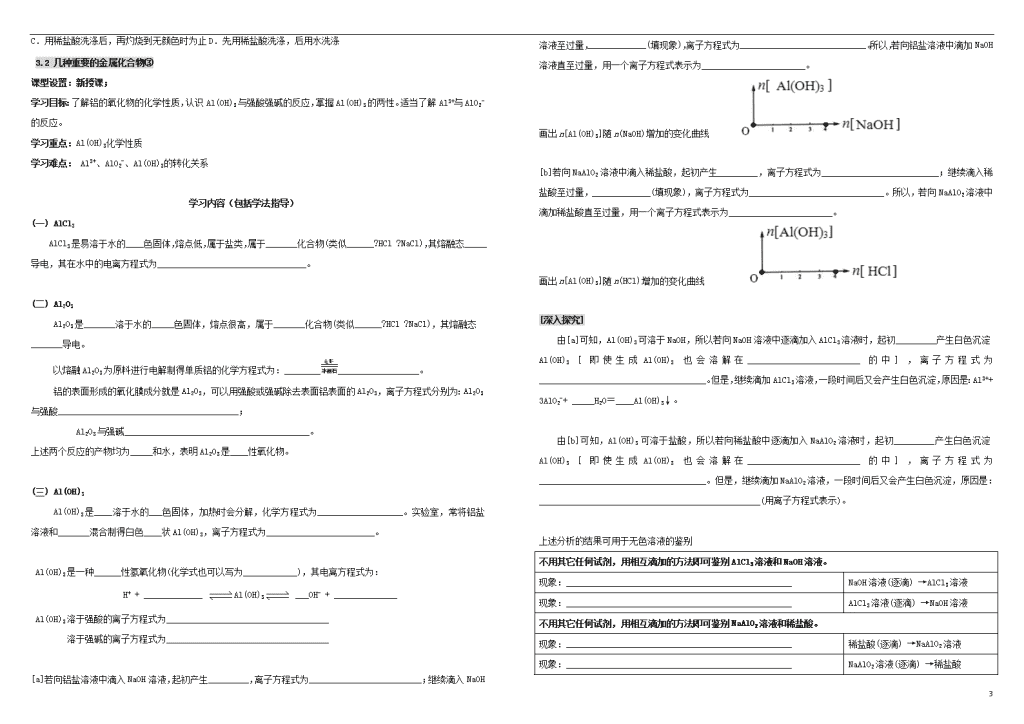
3.2 几种重要的金属化合物① 课型设置:新授课; 学习目标:回顾金属的通性;了解金属的化学性质与原子结构之间的关联;掌握金属与非金属的反应,金属与水的反应。 学习重点:Na2O2的化学性质 钠的碳酸盐的性质 学习难点:Na2O2的化学性质 学习内容(包括学法指导) 一、钠的重要化合物 1、氧化物 Na2O Na2O2 ____色固体 ____色固体 _____性氧化物 与水反应的化学方程式 (a)________________________________________ 与CO2反应的化学方程式 (b)_______________________________________ 是否是碱性氧化物? _____ 与水反应的化学方程式 (c)_______________________________________ 与CO2反应的化学方程式 (d)_______________________________________ *在(c)、(d)中标出转移电子方向和数目; *(c)、(d)反应均为_______热反应。 Na2O中,阴、阳离子个数比为1:2,每个原子最外层均达到稳定结构,电子式为: ________________ Na2O2中,阴、阳离子个数比也是1:2,每个原子最外层均达到稳定结构,电子式为: ____________ 其阴离子的化学式为__________, 名称为________________。 Na2O转化为Na2O2的化学方程式为_____________________________________________________, 这表明两种氧化物中,相对稳定的是____________________。 写出Na2O2与稀盐酸反应的化学方程式___________________________________________。 保存Na2O2时,应注意密封以隔绝____________和______________。 若向盛有Na2O2粉末的试管中滴几滴酚酞试液,先出现红色(因为________________________)且有气体产生,后红色又褪去(红色酚酞是一种有机色质,因Na2O2具有_______性将其氧化为无色物质,发生褪色)。 2、碳酸盐 Na2CO3 NaHCO3 属于碳酸_____盐, 白色粉末,易溶于水(溶解度比NaHCO3更______) 属于碳酸_____盐, 白色晶体,易溶于水 向装有Na2CO3粉末的试管中滴几滴水,触摸试管底部,有________现象。 Na2CO3粉末遇水生成Na2CO3晶体(一般可以简单地认为是_______________________),该晶体在干燥的空气中逐渐失去________变为Na2CO3粉末。 向分别装有等质量Na2CO3、NaHCO3的2支试管中,滴加相同浓度的稀盐酸,产生气体更快,反应更剧烈的是________。 反应的离子方程式分别为: (a)__________________________________ (b)_______________________________________ 若将(a)处理为两步进行,离子方程式为: (a)①___________________________________(a)②___________________________________。 *此实验可用于鉴别_____态的Na2CO3、NaHCO3 分别对Na2CO3、NaHCO3的2支试管进行加热,产生能使澄清石灰水变浑浊气体(CO2)的,是________。 产生气体的反应方程式为_____________________________________。 *此实验可用于鉴别_____态的Na2CO3、NaHCO3 若分别向Na2CO3、NaHCO3溶液中,分别滴几滴稀CaCl2溶液,出现白色沉淀的是__________,离子方程式为___________________________________________。 *此实验可用于鉴别Na2CO3、NaHCO3的_______ 注意,若分别滴几滴Ca(OH)2溶液,则无法鉴别Na2CO3、NaHCO3溶液,原因是_______________。 若分别向Na2CO3、NaHCO3溶液中,滴几滴酚酞试液,溶液均显_____色,红色更深的是________。 *此实验可用于鉴别Na2CO3、NaHCO3的_______(但应控制两者的_______相同) 虽然都属于____________类,但它们的溶液都显_________性,都可以作为食用碱。 除去Na2CO3固体中的NaHCO3杂质,方法是_________________________________。 除去NaHCO3溶液中的Na2CO3杂质,方法是__________________________________________,反应的化学方程式为__________________________________________________。 不用其它任何试剂,用相互滴加的方法即可鉴别稀盐酸和NaHCO3溶液。 若立即产生气体 将____________逐渐滴加到____________________中 若起初无现象,一段时间后产生气体 将____________逐渐滴加到____________________中 4 3.2 几种重要的金属化合物② 课型设置:新授课; 学习目标:进一步认识Na2O2与H2O反应、与CO2反应的原理;学会处理Na2O2固体少量、过量不同情况下反应的计算技巧。 学习重点:Na2O2与H2O反应、与CO2反应的计算问题 学习难点:Na2O2与H2O反应、与CO2反应的计算问题 导·学·展·评·馈 学习内容(包括学法指导) 一、关于Na2O2固体的计算问题 1、(1)Na2O2与H2O反应的化学方程式为___________________________________。 18gH2O与足量的Na2O2固体充分反应后,固体增重______g。从形式上看,固体质量的增加相当于“H2O”中的 “_______”。 Na2O2与CO2反应的化学方程式为___________________________________。 44g CO2与足量的Na2O2固体充分反应后,固体增重______g。从形式上看,固体质量的增加相当于“CO2”中的 “_______”。 (2)2gH2充分燃烧(O2足量)后的产物,通入足量的Na2O2固体中充分反应,固体增重______g。 28gCO充分燃烧(O2足量)后的产物,通入足量的Na2O2固体中充分反应,固体增重______g。 从形式上看,O2相当于运载工具,不断地向Na2O2固体中输送形式上的“_________”、“________” (3)A g H2和CO充分燃烧(O2足量)后的产物,通入足量的Na2O2固体中充分反应,固体增重______g。 B g C6H12O6充分燃烧(O2足量)后的产物,通入足量的Na2O2固体中充分反应,固体增重______g。 16 g CH4充分燃烧(O2足量)后的产物,通入足量的Na2O2固体中充分反应,固体增重______g。 2、(1)若将1mol水蒸气、1mol CO2的混合气体,通入盛有1molNa2O2固体的密闭容器中充分反应,最终容器内各组分及其物质的量为_____________________________________________________。 析:假设水蒸气先与1molNa2O2反应,会得到_______molNaOH和__________,生成的NaOH还可以再与________反应。所以,处理水蒸气、CO2的混合气体与一定量Na2O2固体反应的计算问题时,视为__________与Na2O2固体反应,若Na2O2固体有剩余,剩余Na2O2再与_______反应。 (2)若将1mol水蒸气、1mol CO2的混合气体,通入盛有1.5molNa2O2固体的密闭容器中充分反应,最终容器内各组分及其物质的量为_____________________________________________________。 3、(1) 1molNa2O2固体和2mol NaHCO3固体置于密闭容器中加热并充分反应,反应后,容器内固体成分及物质的量为______________________________________________________________。 (2) 1molNa2O2固体和1mol NaHCO3固体置于密闭容器中加热并充分反应,反应后,容器内固体成分及物质的量为______________________________________________________________。 (3) 1molNa2O2固体和3mol NaHCO3固体置于密闭容器中加热并充分反应,反应后,容器内固体成分及物质的量为______________________________________________________________。 二、焰色反应 焰色反应是某些金属的单质或者______________(无论是固体还是溶液)在灼烧时,火焰所呈现的特殊颜色。一般认为,焰色反应中发生的变化为_______变化。 常用焰色反应检验_________元素的种类。钠元素的焰色为______色;钾元素的焰色为______色;铜元素的焰色为______色。 焰色反应使用的金属丝宜使用______(或用光亮洁净的铁丝替代),通常要求金属丝熔点较_____,本身无焰色,抗氧化性强。 观察钾元素的焰色时,需要透过______________观察。 焰色反应的步骤: ①酸洗(通常使用_________清洗金属丝) ②灼烧(灼烧至与酒精灯火焰颜色一致) ③蘸取样品 ④观察焰色 ⑤酸洗 做焰色反应实验时所用的铂丝,每次用完后都要( ) A.用滤纸擦干净后才能使用 B.用水多洗几次 4 C.用稀盐酸洗涤后,再灼烧到无颜色时为止D.先用稀盐酸洗涤,后用水洗涤 3.2 几种重要的金属化合物③ 课型设置:新授课; 学习目标:了解铝的氧化物的化学性质,认识Al(OH)3与强酸强碱的反应,掌握Al(OH)3的两性。适当了解Al3+与AlO2-的反应。 学习重点:Al(OH)3化学性质 学习难点: Al3+、AlO2-、Al(OH)3的转化关系 学习内容(包括学法指导) (一) AlCl3 AlCl3是易溶于水的____色固体,熔点低,属于盐类,属于_______化合物(类似______?HCl ?NaCl),其熔融态_____导电,其在水中的电离方程式为_________________________________。 (二) Al2O3 Al2O3是_______溶于水的_____色固体,熔点很高,属于_______化合物(类似______?HCl ?NaCl),其熔融态_______导电。 以熔融Al2O3为原料进行电解制得单质铝的化学方程式为:__________________________。 铝的表面形成的氧化膜成分就是Al2O3,可以用强酸或强碱除去表面铝表面的Al2O3,离子方程式分别为:Al2O3与强酸________________________________________; Al2O3与强碱_________________________________________。 上述两个反应的产物均为_____和水,表明Al2O3是____性氧化物。 (三) Al(OH)3 Al(OH)3是____溶于水的___色固体,加热时会分解,化学方程式为___________________。实验室,常将铝盐溶液和_______混合制得白色____状Al(OH)3,离子方程式为________________________。 Al(OH)3是一种______性氢氧化物(化学式也可以写为____________),其电离方程式为: H+ + _____________ Al(OH)3 ___OH- + ______________ Al(OH)3溶于强酸的离子方程式为____________________________________ 溶于强碱的离子方程式为____________________________________ [a]若向铝盐溶液中滴入NaOH溶液,起初产生_________,离子方程式为_________________________;继续滴入NaOH溶液至过量,_____________(填现象),离子方程式为____________________________。所以,若向铝盐溶液中滴加NaOH溶液直至过量,用一个离子方程式表示为_______________________。 画出n[Al(OH)3]随n(NaOH)增加的变化曲线 [b]若向NaAlO2溶液中滴入稀盐酸,起初产生_________,离子方程式为__________________________;继续滴入稀盐酸至过量,_____________(填现象),离子方程式为______________________________。所以,若向NaAlO2溶液中滴加稀盐酸直至过量,用一个离子方程式表示为_______________________。 画出n[Al(OH)3]随n(HCl)增加的变化曲线 [深入探究] 由[a]可知,Al(OH)3可溶于NaOH,所以若向NaOH溶液中逐滴加入AlCl3溶液时,起初_________产生白色沉淀Al(OH)3 [即使生成Al(OH)3也会溶解在_________________________的中],离子方程式为_____________________________________。但是,继续滴加AlCl3溶液,一段时间后又会产生白色沉淀,原因是:Al3++ 3AlO2-+ _____H2O=____Al(OH)3↓。 由[b]可知,Al(OH)3可溶于盐酸,所以若向稀盐酸中逐滴加入NaAlO2溶液时,起初_________产生白色沉淀Al(OH)3 [即使生成Al(OH)3也会溶解在_________________________的中],离子方程式为_____________________________________。但是,继续滴加NaAlO2溶液,一段时间后又会产生白色沉淀,原因是:_________________________________________________(用离子方程式表示)。 上述分析的结果可用于无色溶液的鉴别 不用其它任何试剂,用相互滴加的方法即可鉴别AlCl3溶液和NaOH溶液。 现象:__________________________________________________ NaOH溶液(逐滴) →AlCl3溶液 现象:__________________________________________________ AlCl3溶液(逐滴) →NaOH溶液 不用其它任何试剂,用相互滴加的方法即可鉴别NaAlO2溶液和稀盐酸。 现象:__________________________________________________ 稀盐酸(逐滴) →NaAlO2溶液 现象:__________________________________________________ NaAlO2溶液(逐滴) →稀盐酸 4 3.2 几种重要的金属化合物④ 课型设置:新授课; 学习目标:了解铁的氧化物、铁的氢氧化物的主要性质;掌握Fe2+和Fe3+的相互转化 学习重点:Fe(OH)2的性质;Fe3+的检验 学习难点:Fe2+的检验;Fe2+和Fe3+的转化 学习内容(包括学法指导) (一) 铁的氧化物 Fe2O3(俗称___________)是______溶于水的_____色固体,属于_____性氧化物,其与稀盐酸反应的离子方程式为______________________________________。 Fe3O4 (俗称_______________)是_______溶于水的_____色______体,不属于碱性氧化物,其与稀盐酸反应的离子方程式为________________________________________。 FeO是______溶于水的_______色固体,属于_______性氧化物,FeO与稀盐酸反应的离子方程式为______________________________;FeO溶于稀硝酸的离子方程式为_____H+ + ____ NO3- +_____FeO= ____________________________(已知还原产物为NO)。FeO不稳定,在空气中受热迅速被氧化成Fe3O4,化学方程式为____________________________________。 (二) 铁的氢氧化物 实验室通常用FeCl3溶液与NaOH溶液反应制备Fe (OH)3,离子方程式为_______________________。生成的Fe (OH)3是_______色固体,是一种_____溶的_____碱,它与稀硫酸反应的离子方程式为___________________________。Fe (OH)3受热分解反应的化学方程式:_____________________。 实验室通常用FeSO4溶液与NaOH溶液反应制备Fe (OH)2,离子方程式为_______________________。生成的Fe (OH)2是_____色______状固体,是一种_____溶的_____碱。它与稀盐酸反应的离子方程式为_________________________,它与稀硝酸的离子方程式为__________________________________。 生成的Fe (OH)2露置在空气中,迅速变为_______色,最终变为_______色,该过程的化学方程式为____________________________________________。 (三) Fe2+和Fe3+ 1、鉴别两种液体分别为FeCl3溶液、FeCl2溶液,最简单的方法是: __________________________。 2、(1)向FeCl3溶液中滴加KSCN(名称_____________)溶液,溶液变为__________色,离子方程式为____________________________。可利用这一反应进行______的检验。 若向反应后的液体中,加入铁粉,充分振荡,会观察到液体_________________,原因是(用离子方程式表示)____________________________________________。 (2) 向FeCl2溶液中滴加KSCN溶液,溶液______________,再向其中滴加氯水(主要成分视为Cl2),溶液变为_______色。可以认为是发生了反应,_____Fe2+ +__ Cl2 =___________________,其生成的________(离子符号)再与__________(离子符号)结合。 由此可知,仅用KSCN溶液,_____鉴别Fe2+。鉴别Fe2+的方法是:取____________,向其中滴加KSCN溶液后___________,再加入氯水/硝酸/双氧水(等__________剂),若液体变为______色,则待测液中含有Fe2+。 综上所述,要实现如图转化中的(1) (2) (3) 需要加入氧化剂,而实现(4) (5) (6)需要加入还原剂。 相比较而言,(1)中加入氧化剂的氧化性应当强于_____,而 (2) 中加入氧化剂的氧化性应当强于______。(4)中加入还原剂的还原性应当强于__________ ,而(5) 中加入还原剂的还原性应当强于_______。 如,(1)稀盐酸、CuSO4溶液、S单质(加热)、碘单质(加热)【化学方程式_____________】 如,(2) KMnO4溶液、O2、Cl2、Br2【离子方程式________________________________】 如,(3) 硝酸、Cl2【化学方程式__________________________________】、Br2 如,(4) 活泼性强于_____的金属(Al/Zn)等 如,(5) Fe、Cu【离子方程式_______________________】、KI【离子方程式_____________________】 如,(6)___量的Al/Zn 课堂反馈 1、加热Fe (OH)2固体能得到对应价态的铁的氧化物吗?____。原因________________________。 2、存放少量FeCl2溶液溶液时为了避免其迅速变质,通常向溶液中加入_______。 3、Fe(OH) 2不稳定,空气中迅速变质。若FeSO4溶液和NaOH溶液为原料反应制取Fe(OH) 2时,为了沉淀颜色能保持较长时间,可以考虑采取如下措施:①在反应液上方___________、②事先煮沸_________溶液以减少其中的_________、③使用长胶头滴管,将滴管伸至____________________再挤出液体。 若使用如图所示装置,选用Fe、NaOH溶液、稀硫酸作反应物,则试管A中盛放的试剂为____________,试管B中盛放的试剂为_________________,引发试管A、B中溶液混合的操作是__________________________;进行此操作前的一个步骤中需要首先_________________,Fe(OH)2沉淀最终产生于试管__________中。 4查看更多