- 2021-07-02 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年福建省连城县第一中学高二上学期月考一化学试题 word版
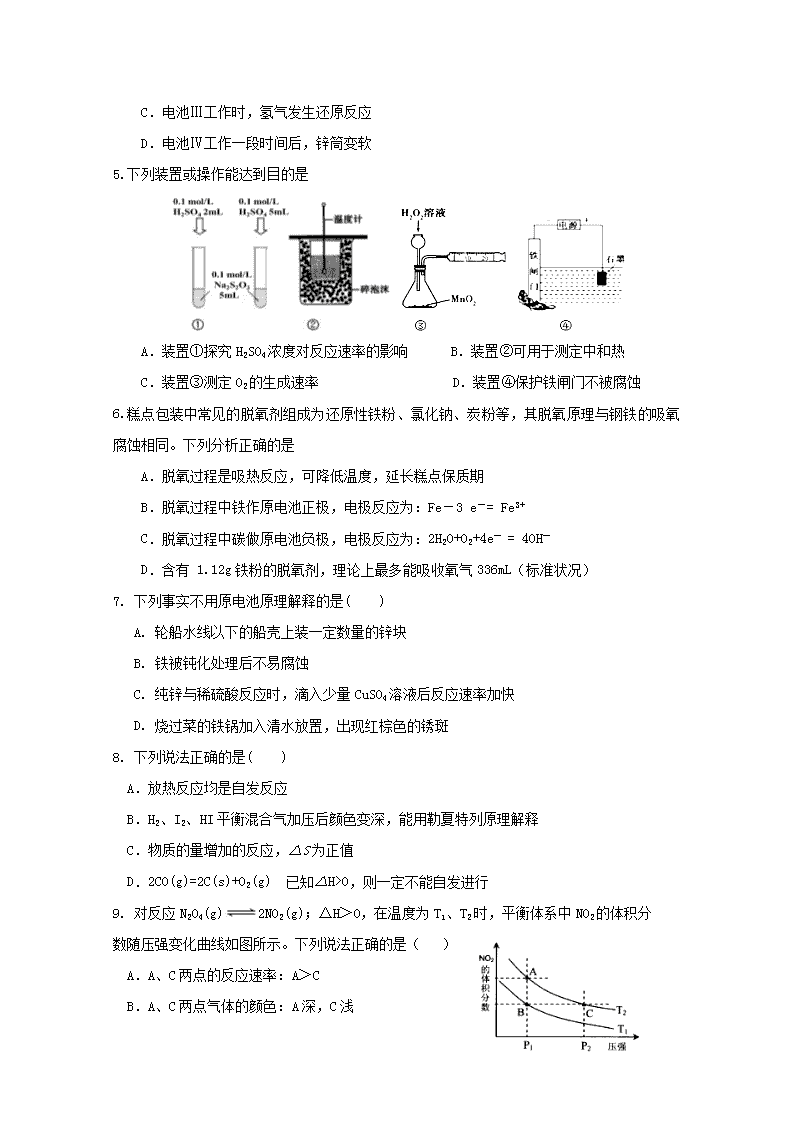
连城一中2019-2020学年上期高二年级月考一化学 满分100分 考试时间90分钟 可能用到的相对原子质量:H-1 O-16 C-12 Ca-40 一、选择题(每题只有1个正确选项,每题3分,共48分) 1.下列说法正确的是( ) A.“煮豆燃豆萁,豆在釜中泣”诗中涉及的能量变化主要是化学能转化为热能和光能 B.已知4P(红磷,s)== P4(白磷,s)△H=+17 kJ/mol ,则白磷比红磷更稳定 C.同温同压下,H2(g)+Cl2(g) == 2HCl(g)在光照和点燃条件下的ΔH不同 D.已知 H+(aq) + OH-(aq) === H2O(aq) △H= —57.3kJ/mol ,则1molH2SO4与1mol Ba(OH)2的反应热△H=2×(—57.3) kJ/mol 2.反应2A(g) 2 B(g)+C(g) △H>0,达平衡时要使v正降低、c(A)增大,应采取的措施是( ) A. 加压 B. 减压 C. 升温 D. 降温 3.在恒温恒容的密闭容器中,发生可逆反应2NO(g) + O2(g)2NO2(g),不能说明该反应已经达到平衡状态的是( ) A.正反应生成NO2的速率和逆反应生成NO的速率相等 B.混合气体的密度不随时间延长而变化 C.混合气体颜色深浅保持不变 D.反应容器中压强不随时间的延长而变化 4.下列关于化学能转化为电能的四种装置的说法正确的是( ) A.电池Ⅰ工作时,电子由锌经过电解质溶液流向铜 B.电池Ⅱ是一次电池 C.电池Ⅲ工作时,氢气发生还原反应 D.电池Ⅳ工作一段时间后,锌筒变软 5.下列装置或操作能达到目的是 A.装置①探究H2SO4浓度对反应速率的影响 B.装置②可用于测定中和热 C.装置③测定O2的生成速率 D.装置④保护铁闸门不被腐蚀 6.糕点包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同。下列分析正确的是 A.脱氧过程是吸热反应,可降低温度,延长糕点保质期 B.脱氧过程中铁作原电池正极,电极反应为:Fe-3 e-= Fe3+ C.脱氧过程中碳做原电池负极,电极反应为:2H2O+O2+4e- = 4OH- D.含有 1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) 7. 下列事实不用原电池原理解释的是( ) A. 轮船水线以下的船壳上装一定数量的锌块 B. 铁被钝化处理后不易腐蚀 C. 纯锌与稀硫酸反应时,滴入少量CuSO4溶液后反应速率加快 D. 烧过菜的铁锅加入清水放置,出现红棕色的锈斑 8. 下列说法正确的是( ) A.放热反应均是自发反应 B.H2、I2、HI平衡混合气加压后颜色变深,能用勒夏特列原理解释 C.物质的量增加的反应,△S为正值 D.2CO(g)=2C(s)+O2(g) 已知△H>0,则一定不能自发进行 9. 对反应N2O4(g)2NO2(g);△H>0,在温度为T1、T2时,平衡体系中NO2的体积分 数随压强变化曲线如图所示。下列说法正确的是( ) A.A、C两点的反应速率:A>C B.A、C两点气体的颜色:A深,C浅 C.由状态B到状态A,可以用加热的方法 D.B、C两点NO2的体积分数相同,所以平衡常数也相同 10.“碳呼吸电池”是一种新型能源装置,其工作原理如下图。下列说法错误的是( ) A.该装置是将化学能转变为电能 B.每得到1 mol草酸铝,电路中转移3mol电子 C.正极的电极反应:2CO2 + 2e-=== C2O D.利用该技术可捕捉大气中的CO2 11.已知反应:2NO2(红棕色)N2O4(无色)△H<0。将一定量的NO2充入注射 器中并密封,改变活塞位置的过程中,气体透光率随时间的变化如图所示(气体颜色 越深,透光率越小)。下列说法不正确的是( ) A.b点达到平衡状态 B.b点与a点相比,c(NO2)、c(N2O4)均减小 C.d点:v(正)<v(逆) D.若在c点将温度降低,其透光率将增大 12.下列图像不符合反应Fe(s)+H2O(g)FeO(s)+H2(g) ΔH<0 的是( ) (图中v是速率,φ为混合物中H2的体积百分含量) 13.在KIO3、KHSO3的酸性混合溶液中加入少量KI和淀粉,不停地搅拌,有下列反应发生: ①IO3-+5I-+6H+===3I2+3H2O;②I2+HSO3-+H2O===2I-+SO42-+3H+。当反应进行到15 min时,溶液颜色迅速变蓝,随之又很快消失,这一反应称为时钟反应,有人用它来解释生物钟现象,下列说法中错误的是( ) A.在整个反应过程中,起催化作用的物质是KI B.时钟反应的快慢由反应②决定 C.上述两个反应中,反应速率较快的是② D.“溶液颜色迅速变蓝,随之又很快消失”这一现象与①②的反应速率有关 14.某密闭容器中发生如下反应:2X(g)+Y(g) 2Z(g) △H<0,下图是表示该反应速率(v)随时间(t)变化的关系图。t1、t2、t5时刻外界条件均有改变(但都没有改变各物质的用量)。则下列说法中正确的是( ) A. t6时刻后反应物的转化率最低 B. t5时增大了压强 C. t3时降低了温度 D. t4时该反应的平衡常数小于t6时反应的平衡常数 15.某温度下,将3molA和2molB充入2L一密闭容器中,发生反应:A(g)+B(g)⇌C(g)+D(g),5min后达到平衡。已知该温度下其平衡常数K=1,下列选项正确的是 ( ) A.A的转化率为40% B.速率v(B)= 0.08 mol/(L•min) C.C平衡浓度为1.2mol/L D.B的转化率为40% 16.将1molN2气体和3molH2气体在2L的恒容容器中,并在一定条件下发生如下反应:N2(g)+3H2(g)=2NH3(g),若经2s后测得NH3的浓度为0.6mol·L-1,现有下列几种说法:其中不正确的是( ) A. 用N2表示的反应速率为0.15molL-1·s-1 B. 2s时H2的转化率为40% C. 2s时N2与H2的转化率相等 D. 2s时H2的浓度为0.6mol·L-1 17.(12分)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下方法来合成甲醇: (1)用CO2生产甲醇。 已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(l) △H=﹣akJ•mol﹣1; 2H2(g)+O2(g)═2H2O(l) △H=﹣b kJ•mol﹣1; 则表示CH3OH(g)燃烧的热化学方程式为:____________________。 (2)用CO生产甲醇。 已知:CO(g)+2H2(g) CH3OH(g),下图是该反应在不同温度下CO的转化率随时间变化的曲线。 ① 该反应的焓变ΔH__________0(填“>”、“<”或“=”)。 ② T1和T2温度下的平衡常数大小关系是K1_______K2 (填 “>”、“<”或“=”)。 ③ 若容器容积不变,下列措施可增加甲醇产率的是______________。 A. 升高温度 B. 将CH3OH(g)从体系中分离 C. 使用合适的催化剂 D. 充入He,使体系总压强增大 (3)甲醇(CH3OH)可以用作燃料电池,该电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。负极发生的电极反应式是 ,正极发生的电极反应式是 。 18.(14分)如图所示三套实验装置,分别回答下列问题。 图1 图 2 图 3 (1)图1中,① 若开始时开关K与a连接,则该装置为_____(填装置名称),电极A的电极反应式为________________________ ②若开始时开关K与b连接,则总反应的离子方程式为 ___________________________ (2)2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,电池示意如图2所示: ①______极(填a或b)为电池的正极,电池工作时电子的流向为_________(填a→b或b→a) ②写出该电池负极的电极反应式________________________________________ (3)用图3装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。 ①该电解槽的阴极反应式为 _____________________。 ②制得的硫酸溶液从出口__________________________(填“A”、“D”)导出,并简述原因 ____________________________________________________________________________ ____________________________________________________(请用化学用语和文字解释) 19.(13分) (Ⅰ)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00 mL,大理石用量为10.00 g。 (1)请完成以下实验设计表,并在实验目的一栏中填空: 实验编号 温度(℃) 大理石规格 HNO3浓度(mol/L) 实验目的 ① 25 粗颗粒 2.00 (Ⅰ)实验①和②探究浓度对反应速率的影响;(Ⅱ)实验①和③探究温度对反应速率的影响;(Ⅲ)实验①和④探究e_______对反应速率的影响 ② 25 粗颗粒 a______ ③ b_______ 粗颗粒 2.00 ④ c________ 细颗粒 d______ (2)实验①中CO2质量随时间变化的关系见下图。计算实验①中70 s~90 s范围内用HNO3表示的平均反应速率________(忽略溶液体积变化,不需要写出计算过程)。在O~70、70~90、90~200各相同的时间段里,反应速率最大的时间段是________。 (Ⅱ)某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O 实验编号 0.1 mol·L-1酸性KMnO4溶液的体积/mL 0.6mol·L-1H2C2O4溶液的体积/mL H2O的体积/mL 实验温度/℃ 溶液褪色所需时间/min ① 10 V1 35 25 ② 10 10 30 25 ③ 10 10 V2 50 (3)表中V1=_______mL,V2=_______mL。 (4)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是________。 (5)实验①测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=________mol·L-1·min-1。 20.(1)参考合成反应CO(g)+2H2(g) CH3OH(g)的平衡常数,回答下列问题: 温度/℃ 0 50 100 200 300 400 平衡常数 667 100 13 1.9×10-2 2.4×10-4 1×10-5 ①该反应正反应是 (填“放热”或“吸热”)反应; ②在T℃时,1L密闭容器中,投入0.1molCO和0.2molH2,达到平衡时,CO转化率为50%,则T= ℃。 (2)CH3OH也可由CO2和H2合成。在体积为1L的密闭容器中,充入lmolCO2和3molH2,一定条件下反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH= — 49.0kJ/mol,测得CO2和CH3OH(g)浓度随时间变化如图所示。 ①该反应的平衡常数表达式为K=_____________________; 从反应开始到10min,v(H2)=______________________mol·L-1·min-1; ②下列情况能说明该反应一定达到平衡状态的是___________(填字母) A.v(CO2)消耗 = v(CH3OH)生成 B.气体的密度不再随时间改变 C.CO2和CH3OH的浓度之比不再随时间改变 D.气体的平均相对分子质量不再随时间改变 ③为了加快化学反应速率且使体系中气体的物质的量增大,只改变下列某一条件,可采取的措施有___________ (填字母) A.升高温度 B.缩小容器体积 C.再充入CO2气体 D.使用合适的催化剂 ④相同温度下,在另一个容积为1 L的密闭容器中充入2mol CH3OH(g)和2molH2O(g),达到平衡时CO2的浓度____________(填“>”、“ <”或“=”)0.25mol·L-1。 连城一中2019-2020学年上期高二年级月考一化学 答题卷 题号 1 2 3 4 5 6 7 8 答案 题号 9 10 11 12 13 14 15 16 答案 17.( 每空2分,共12分) (1)________________________________________________________ (2)①________ ②___________ ③ ______________ (3)________________________________________________________ ________________________________________________________ 18.(14分) (1). ________________(1分) ____________________________________________________________ ____________________________________________________________ (2).___________(1分) __________________(1分) ____________________________________________________________ (3)._______________________________________________________ ___________(1分) ______________________________________________________ _______________________________________________________________________________________________________________________________________________ 19.(每空1分,共12分) (1) a__________ b_____________ c______________ d______________ e____________________ (2) __________________________________________________________ ______________________________________________________________ (3)____________ _____________ (4)___________________ ___________________ (5)__________________________ 20. (每空2分,共14分) (1)①_______________ ②____________________ (2)①_________________________ _______________________ ②____________ ③_______________ ④_____________________ 连城一中2019-2020学年上期高二年级月考一化学 参考答案 题号 1 2 3 4 5 6 7 8 答案 A D B D D D B D 题号 9 10 11 12 13 14 15 16 答案 C B B A B A A B 17.( 每空2分,共12分) (1)2CH3OH(g)+3O2(g) =2CO2 (g)+4H2O(l) ΔH = + (2a -3b) kJ·mol-1 (2)① < ② > ③ B (3)2CH3OH -12e-+2H2O=2CO2+12H+ 3O2 + 12H+ + 12e- =6H2O 18.(14分)(1). 原电池(1分) 2H2O+O2+4e-=4OH- 2H2O+2Cl-2OH-+H2↑+Cl2↑ (2).b (1分) a→b (1分) C2H5OH-12e-+3H2O=12H++2CO2 (3).2H2O+2e-=2OH-+H2↑ 或2H++2e-=H2↑ A(1分) 2H2O-4e-=4H++O2↑,OH-在阳极放电,使水的电离平衡正向移动,c(H+)增大(1分);SO42-通过阴离子交换膜进入阳极,和H+结合成硫酸(1分)(不注明的各2分) 19.(每空1分,共12分) (1) 1.00 35 25 2.00 大理石规格(2) 0.01 mol/(L·s) 0-70(不注明的各1分) (3) 5 30 (4) ②和③ ①和② (5) 0.025 20. (每空2分,共14分)(1)①放热; ②50 (2)①;0.225 ②CD ③AC ④ >查看更多