安徽省天长市炳辉中学2019-2020学年高二上学期月考化学试题
选修四化学试卷
考试范围:选修四;考试时间:90分钟;
注意:本试卷包含Ⅰ、Ⅱ两卷。第Ⅰ卷为选择题,所有答案必须用2B铅笔涂在答题卡中相应的位置。第Ⅱ卷为非选择题,所有答案必须填在答题卷的相应位置。答案写在试卷上均无效,不予记分。
可能用到的相对原子质量:H 1 C 12 O 16
第Ⅰ卷(选择题 共48分)
本卷共16小题,每小题3分,每小题只有一个选项符合题意。答案填涂到答题卡上。
1.化学与生活密切相关。下列分析不正确的是( )
A. “煮豆燃豆萁,豆在釜中泣”,句中涉及的能量变化主要是化学能转化为热能和光能
B. 食品添加剂可以改善食品品质及延长食品保存期,在添加时无需对其用量进行严格控制
C. 华为发布的首款5G折叠屏手机,用镁铝合金制成的手机外壳具有轻便抗压的特点
D. 绿色化学是指在化学产品的设计、开发和加工生产过程中减少使用或产生对环境有害物质的科学
【答案】B
【解析】
【详解】A.“豆箕”是大豆的秸秆,主要成分为纤维素,燃烧纤维素的过程是把纤维素中的化学能转化为热能和光能,故A正确;
B.过量使用国家允许使用的食品添加剂,对人体是有害的,故B错误;
C.镁铝合金的密度较小,制成的手机外壳具有轻便抗压的特点,故C正确;
D.“绿色化学”是21世纪化学发展的主导方向,其目的是化学产品在设计、制造、应用、回收处理时,对环境没有或产生尽可能小的副作用,故D正确;
故选B。
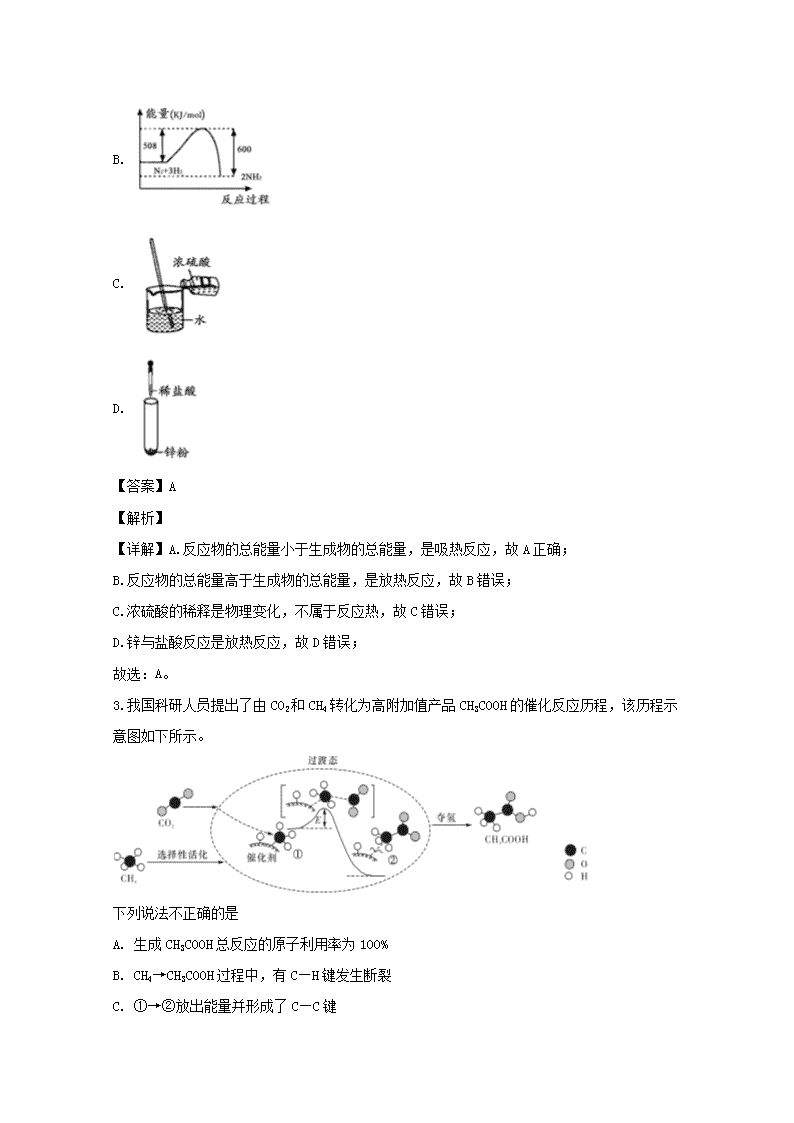
2.下列图示变化为吸热反应的是
A.
B.
C.
D.
【答案】A
【解析】
【详解】A.反应物的总能量小于生成物的总能量,是吸热反应,故A正确;
B.反应物的总能量高于生成物的总能量,是放热反应,故B错误;
C.浓硫酸的稀释是物理变化,不属于反应热,故C错误;
D.锌与盐酸反应是放热反应,故D错误;
故选:A。
3.我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程,该历程示意图如下所示。
下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C—H键发生断裂
C. ①→②放出能量并形成了C—C键
D. 该催化剂可有效提高反应物的平衡转化率
【答案】D
【解析】
分析:A项,生成CH3COOH的总反应为CH4+CO2CH3COOH,原子利用率为100%;B项,CH4选择性活化变为①过程中,有1个C-H键发生断裂;C项,根据图示,①的总能量高于②的总能量,①→②放出能量并形成C-C键;D项,催化剂只影响化学反应速率,不影响化学平衡,不能提高平衡转化率。
详解:A项,根据图示CH4与CO2在催化剂存在时生成CH3COOH,总反应为CH4+CO2CH3COOH,只有CH3COOH一种生成物,原子利用率为100%,A项正确;B项,CH4选择性活化变为①过程中,有1个C-H键发生断裂,B项正确;C项,根据图示,①的总能量高于②的总能量,①→②放出能量,对比①和②,①→②形成C-C键,C项正确;D项,催化剂只影响化学反应速率,不影响化学平衡,不能提高反应物的平衡转化率,D项错误;答案选D。
点睛:本题考查原子利用率、化学反应的实质、化学反应中的能量变化、催化剂对化学反应的影响,解题的关键是准确分析示意图中的信息。注意催化剂能降低反应的活化能,加快反应速率,催化剂不能改变ΔH、不能使化学平衡发生移动。
4.在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g) 2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )
A. ③②① B. ③①② C. ①②③ D. ②①③
【答案】A
【解析】
【详解】3A(g)+B(g) 2C(g)是体积减小的、放热的可逆反应。①容器反应过程中,体积不变,温度升高,与容器②相比,相当于升温,不利于反应正向移动,C物质的体积分数②>①;③容器体积可变、压强不变,正反应体积减小,所以③中的压强始终高于②,有利于反应正向移动,C物质的体积分数③>②,达到平衡时各容器中C物质的体积分数由大到小的顺序为③②①,故选A。
【点睛】本题考查温度、压强对化学平衡移动的影响,能正确分析①②容器温度变化、②③压强变化是解题的关键。
5.将2molA气体和1mol B气体在固定体积的密闭容器中混合并在一定条件下发生如下反应并达到平衡状态:2A(g)+B(g)⇌2C(g),此反应为放热反应.下列能增大正、逆反应速率的方法是:
(1)再充入1mol A气体;(2)充入2mol的惰性气体;(3)加入正催化剂;(4)升高温度;(5)移走部分C气体.其中正确的是( )
A. (1)(3)(5) B. (1)(3)(4) C. (1)(2)(4)(5) D. (1)(2)(3)(4)(5)
【答案】B
【解析】
【详解】(1)再充入1mol A气体,A气体的浓度增大,正逆反应速率均增大,故正确;
(2)充入2mol的惰性气体,反应物的浓度不变,则反应速率不变,故错误;
(3)加入正催化剂,正逆反应速率同等程度增大,故正确;
(4)升高温度,正逆反应速率均增大,故正确;
(5)移走部分C气体,生成物的浓度减小,正逆反应速率均减小,故错误;
能增大正、逆反应速率的有(1)(3)(4),故选B。
6.在密闭容器中发生如下反应:mA(g)+nB(g)⇌pC(g),达到平衡后,保持温度不变,将容器的体积缩小到原来的一半,达到新平衡时,C的浓度变为原来的1.9倍。下列说法中错误的是( )
A. m+m<p B. 平衡向逆反应方向移动
C. A的转化率降低 D. A的体积分数减小
【答案】D
【解析】
【详解】反应mA(g)+nB(g)⇌pC(g)达到平衡后,保持温度不变,将容器的体积缩小到原来的一半,若平衡不发生移动,则C的浓度应该是原平衡浓度的2倍,但事实上达到新平衡时,C的浓度变为原来的1.9倍,说明增大压强,化学平衡逆向移动,根据平衡移动原理:增大压强,化学平衡向气体体积减小的方向移动,逆反应为气体体积减小的方向。
A.依据上述分析可知,正向是气体体积增大的反应,m+n
”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,如反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6s时c(A)=_____mol·L-1, C的物质的量为______mol;若反应经一段时间后,达到平衡时A的转化率为_____,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为_________;
(3)判断该反应是否达到平衡的依据为______(填正确选项前的字母):
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g)A(g)+B(g)的平衡常数的值为_____________。
【答案】 (1). [c(C)c(D)]/[c(A)c(B)] (2). < (3). 0.022 (4). 0.09 (5). 80% (6). 80% (7). c (8). 2.5
【解析】
【详解】(1)A(g)+B(g)
C(g)+D(g)反应的平衡常数表达式为K=[c(C)c(D)]/[c(A)c(B)];700℃时,平衡常数为1.7,1000℃时,平衡常数为0.6,故温度越高,平衡常数越小,说明此反应为放热反应,即△H<0;
(2)反应初始6s内A的平均反应速率v(A)=0.003mol•L-1•s-1,则6s时△n(A)=0.003mol•L-1•s-1×6s×5L=0.09mol,故A剩余物质的量为:n(A)=0.2mol-0.09mol=0.11mol,则6s时c(A)= =0.022mol/L,根据方程式可知,消耗A0.09mol时,生成C的物质的量为0.09mol;
设平衡时A的浓度变化量为x,则:
A(g)+B(g)C(g)+D(g)
开始(mol/L):0.04 0.16 0 0
变化(mol/L):x x x x
平衡(mol/L):0.04-x 0.16-x x x
故=1,解得x=0.032,所以平衡时A的转化率为×100%=80%,此时C的物质的量为0.032mol/L×5L=0.16mol;如果这时向该密闭容器中再充入1mol氩气,体积不变,平衡没有移动, A的转化率仍为80%;
(3) a.因气体反应物与生成物系数不变,压强始终不随时间改变 ,故a错误;
b.气体的质量不变,体积不变,气体的密度始终不变,故b错误;
c.c(A)不随时间改变,说明反应物或生成物的量一定,是平衡状态,故c正确;
d.单位时间里生成C和D的物质的量相等,此时不一定是平衡状态,故d错误,
答案为c;
(4)由图表知1200℃时反应A(g)+B(g)C(g)+D(g)的平衡常数的值为0.4,则C(g)+D(g)A(g)+B(g)的平衡常数为=2.5。
19.25℃时,取0.lmol•L-1 HA溶液与0.1mol•L-1 NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8,试回答以下问题:
(1)混合溶液的pH=8的原因______(用离子方程式表示)。
(2)混合溶液中由水电离出的c(OH-)______0.1mol•L-1NaOH 溶液中由水电离出的c(OH-) (填“>”、“<”或“=”)。
(3)所得混合液中各离子浓度从大到小的顺序为:______。
(4)混合液中:c(HA)+c(A-)=______ mol•L-1。
(5)25℃时,已知NH4A溶液为中性,将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的 pH______7(填“>”、“<”或“=”)。
(6)相同温度下相同物质的量浓度的下列四种盐溶液,pH由大到小的顺序______(填字母)。
A. NH4HCO3 B. NH4A C. NH4HSO4 D. NH4Cl
【答案】 (1). A-+H2O⇌HA+OH- (2). > (3). c(Na+)>c(A-)>c(OH-)>c(H+) (4). 005 (5). > (6). A>B>D>C
【解析】
【分析】
0.lmol/LHA溶液与0.1mol/LNaOH溶液等体积混合,反应恰好生成NaA,混合溶液的pH=8,溶液为碱性,说明A-水解使溶液呈碱性,据此分析解答(1)~(4);
(5)NH4A溶液为中性,说明NH4+和A-的水解程度相当,将HA溶液加到Na2CO3溶液中有气体放出,说明酸性HA强于H2CO3,据此分析解答;
(6)NH4HSO4中电离出H+,酸性最强,NH4Cl为强酸弱碱盐,水解显酸性,NH4A为中性,酸性强弱HA>H2CO3,据此分析解答。
【详解】(1)0.lmol/LHA溶液与0.1mol/LNaOH溶液等体积混合,反应恰好生成NaA,混合溶液的pH=8,溶液为碱性,说明A-水解,A-+H2O⇌HA+OH-,故答案为:A-+H2O⇌HA+OH-;
(2)NaOH抑制水的电离,NaA水解促进水的电离,所以混合溶液中由水电离出的c(OH-)>0.1mol/LNaOH 溶液中由水电离出的c(OH-),故答案为:>;
(3)溶液呈碱性,则溶液中c(OH-)>c(H+),A-水解,所以溶液中离子浓度大小顺序为:c(Na+)>c(A-)>c(OH-)>c(H+),故答案为:c(Na+)>c(A-)>c(OH-)>c(H+);
(4)反应恰好生成NaA,混合液中存在物料守恒:c(HA)+c(A-)= c(Na+)==0.05mol/L,故答案为:0.05;
(5)NH4A溶液为中性,说明NH4+和A-的水解程度相当,将HA溶液加到Na2CO3溶液中有气体放出,说明酸性HA强于H2CO3,则CO32-水解程度大于A-,因此CO32-水解程度大于NH4+,所以(NH4)2CO3溶液呈碱性,pH>7,故答案为:>;
(6)阴离子水解使溶液呈碱性,阳离子水解使溶液呈酸性,阳离子相同,比较阴离子水解程度,NH4HSO4中电离出H+,酸性最强,pH最小,酸性强弱HCl>HA>H2CO3,其中Cl-不水解,NH4
Cl显酸性,水解程度A-<HCO3-,NH4A为中性,则NH4HCO3显碱性,因此pH由大到小的顺序为:A>B>D>C,故答案为:A>B>D>C。
【点睛】本题的易错点为(6),要注意NH4A为中性,水解程度A-<HCO3-,则NH4HCO3显碱性。
20.依据原电池原理,回答下列问题:
(1)图1是依据氧化还原反应:Cu(s)+2Fe3+(aq)=Cu2+(aq)+2Fe2+(aq)设计的原电池装置。
①电极X的材料是________(填化学名称);电极Y的材料是__________(填化学名称)。
②Y电极发生的电极反应式为:______________。
(2)图2是使用固体电解质的燃料电池,装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导正极生成的O2-离子(O2+4e―→2O2-)。
①c电极为______________极。(填“正”或“负”)
②d电极上的电极反应式为___________________________。
③如果消耗甲烷160g,假设化学能完全转化为电能,则转移电子的数目为______________(用NA表示),需要消耗标准状况下氧气的体积为_______L。
【答案】 (1). 铜 (2). 碳(石墨、金、铂、银) (3). 2Fe3++2e-=2Fe2+ (4). 正 (5). CH4+4O2--8e-=CO2+2H2O (6). 80NA (7). 448
【解析】
【分析】
(1)因为氧化还原反应,Cu(s)+2Fe3+(aq)=Cu2+(aq)+2Fe2+(aq)中,Cu失去电子,化合价升高,是原电池中电子流出的一极,而Fe3+化合价降低,发生还原反应,由此回答;
(2)依据图2电流方向,可以看出①c电极是燃料电池电子流入的一级,为正极;②d电极为电子流出的电极,为燃料电池的负极;③根据电池反应式,计算消耗甲烷160g,转移电子数和需要消耗标准状况下氧气的体积;
【详解】(1)由Cu(s)+2Fe3+(aq)=Cu2+(aq)+2Fe2+(aq)可知:Cu失去电子,化合价升高,是电子流出的一极,为原电池的负极,故电极X的材料是铜,电极Y是原电池的正极,发生Fe3+得电子的还原反应,可选择惰性电极碳或比铜活波性弱的材料做电极,如碳(石墨、金、铂、银)做正极,原电池正极的电极反应式为:2Fe3++2e-=2Fe2+;
本题答案为:铜,碳(石墨、金、铂、银);2Fe3++2e-=2Fe2+(或Fe3++e-=Fe2+)。
(2)有图2电流方向可以看出,①c电极是燃料电池电子流入的一级,为正极;②d电极为电子流出的电极,为燃料电池的负极,负极发生CH4失电子的氧化反应,电极反应式为:CH4+4O2--8e-=CO2+2H2O;③根据电池反应式,CH4 2O2=CO22H2O,160g CH4的物质的量为,n(CH4)==10mol,设有xmol电子转移,则1:8=10:X,解得X=80mol,转移电子电子数目为80NA,消耗O2的物质的量为:n(O2=)20mol,体积V(O2)=20mol22.4L/mol=448L;
本题答案为:正 , CH4+4O2--8e-=CO2+2H2O ,80NA ,448。
21.重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)制备K2Cr2O7的流程如下图所示。
已知:I 在酸性条件下,H2O2能将Cr2O72-还原为Cr3+
II相关金属离子形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)滤渣②的主要成分为___________(填化学式)。
(2)写出“氧化”步骤中反应的化学方程式_______________。
(3)“加热”操作的目的是__________________。
(4)“酸化”过程中发生反应2CrO42-+2H+ Cr2O72-+H2O (K=4×1014 L3.mol3)已知,“酸化”后溶液中c(Cr2O72-)=1.6×10-3mol/L则溶液中c(CrO42-)=_________
(5)“结晶”后得到K2Cr2O7(M=294g.mol-1)产品0.5000 g,将其溶解后用稀H2SO4酸化,再用浓度为1.0000 mol.L-1 (NH4)2Fe(SO4)2标准溶液滴定,滴定终点消耗标准溶液的体积为 9.00 mL,则产品的纯度为_____________。[滴定反应为:K2Cr2O7+6(NH4)2Fe(SO4)2+7H2SO4 =K2SO4 +Cr2(SO4)3 +6(NH4)2SO4+3Fe2(SO4)3+7H2O]
【答案】 (1). Fe(OH)3 (2). 2Cr(OH)3+3H2O2+4KOH=2K2CrO4+8H2O (3). 分解除去过量的H2O2 (4). 2×10-8mol/L (5). 88.2%
【解析】
【分析】
含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)制备K2Cr2O7的流程:废液与足量KOH反应生成沉淀Cr(OH)3、Fe(OH)3,过滤得到滤渣①中含有Cr(OH)3、Fe(OH)3,除去K+、SO42-等离子,碱性条件下在滤渣中加入过氧化氢氧化Cr(OH)3生成K2CrO4,过滤除去Fe(OH)3,得到K2CrO4滤液②,加热除去过量过氧化氢,防止后续加酸时H2O2能将Cr2O72-还原为Cr3+,加酸调pH=1,使K2CrO4溶液转化为K2Cr2O7溶液,蒸发结晶得到K2Cr2O7晶体,据此分析解答。
【详解】(1)根据上述分析,滤渣①成分为Cr(OH)3、Fe(OH)3混合物,“氧化”步骤中Cr(OH)3转化为K2CrO4溶液,Fe(OH)3不反应也不溶与水,过滤分离的滤渣②为Fe(OH)3,故答案为:Fe(OH)3;
(2)“氧化”步骤中,碱性条件下,过氧化氢氧化Cr(OH)3生成K2CrO4溶液,结合电子守恒、原子守恒,反应的化学方程式为2Cr(OH)3+3H2O2+4KOH=2K2CrO4+8H2O,故答案为:2Cr(OH)3+3H2O2+4KOH=2K2CrO4+8H2O;
(3)因为在酸性条件下,H2O2能将Cr2O72-还原为Cr3+,为防止后续“酸化”步骤中H2O2将Cr2O72-还原为Cr3+而混入杂质,所以酸化之前必须除去H2O2,并且H2O2对热不稳定、易分解,可以通过加热除去,故答案为:除去过量的H2O2;
(4)酸化”过程中pH=1,即c(H+)=0.1mol/L,溶液中存在平衡2CrO42-+2H+⇌Cr2O72-+H2O,平衡常数K===4×1014,解得:c(CrO42-)=2×10-8mol•L-1,故答案为:2×10-8mol•L-1;
(5)由反应K2Cr2O7+6(NH4)2Fe(SO4)2+7H2SO4 =K2SO4+Cr(SO4)3+6(NH4)2Fe(SO4)2+3Fe(SO4)3+ 7H2O有n(K2Cr2O7)=n[(NH4)2Fe(SO4)2]=×0.0100mol/L×0.9L=0.0015mol,产品的纯度=
==88.2%,故答案为:88.2%。