- 2021-07-02 发布 |
- 37.5 KB |
- 10页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2017-2018学年广西南宁市第三中学高二下学期期中考试化学试题 Word版
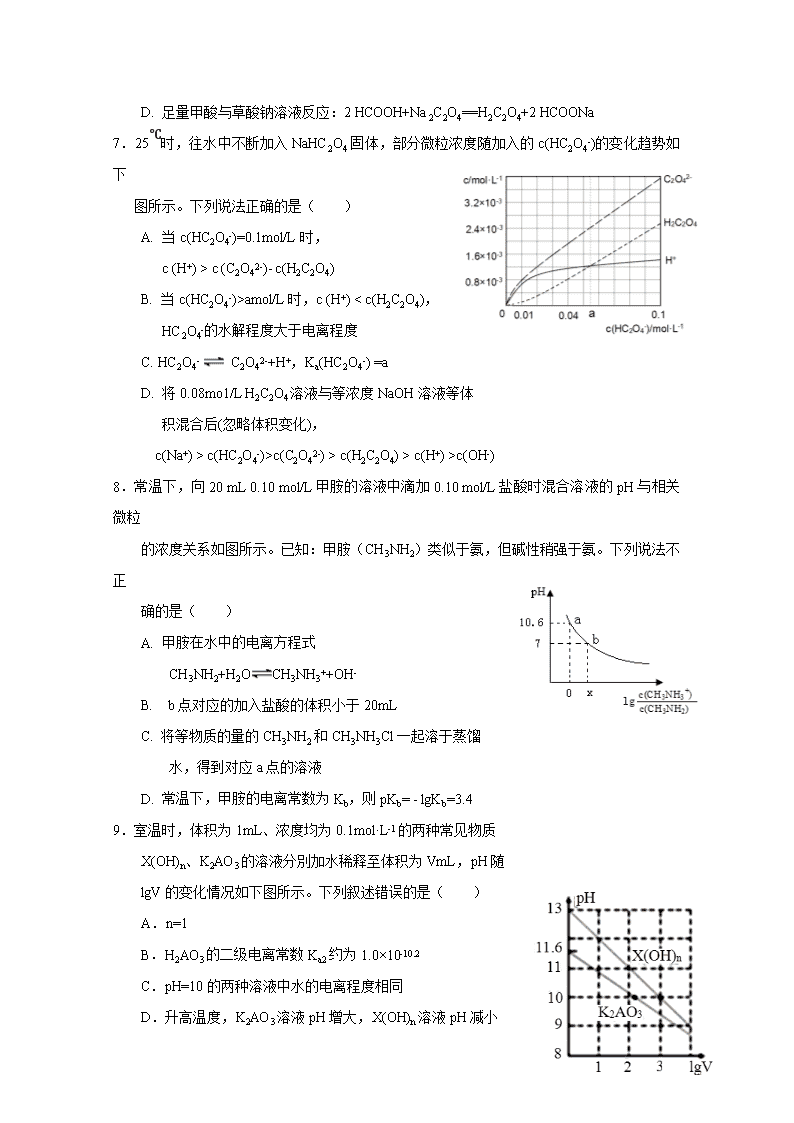
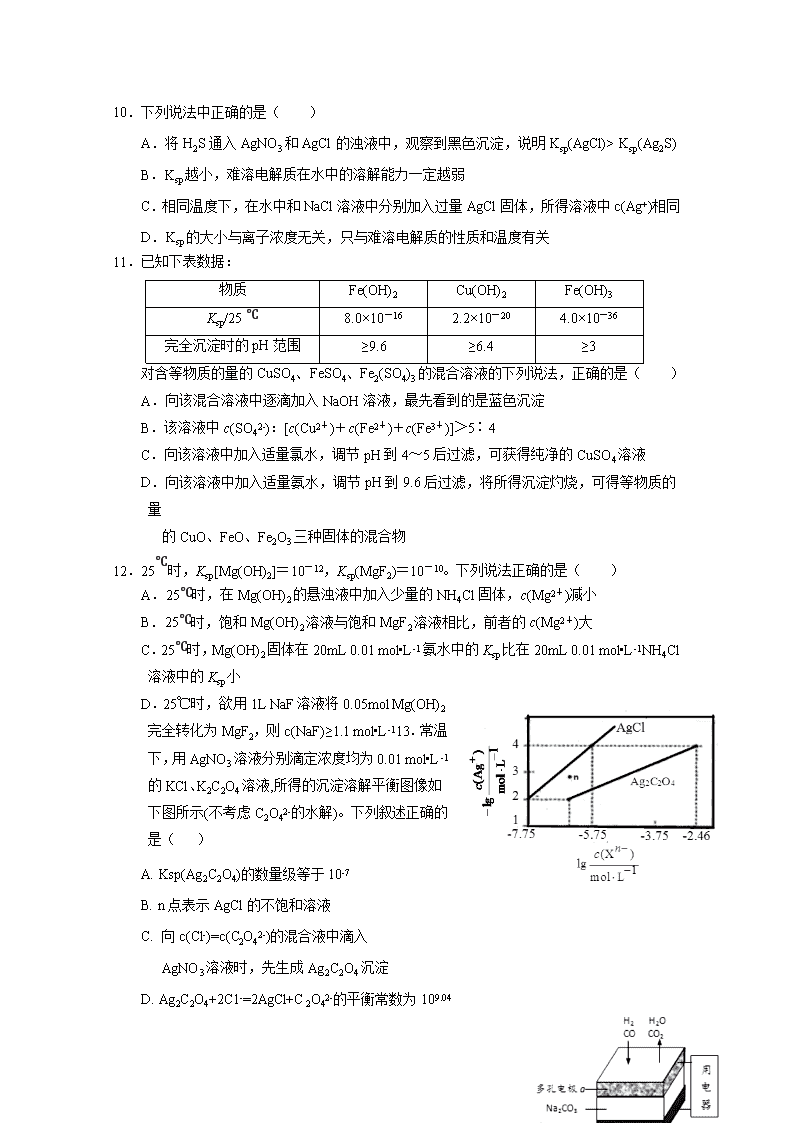
2017-2018 学年广西南宁市第三中学高二下学期期中考试化学试 题 相对原子质量: H-1 N-14 O-16 Mg-24 Al-27 S-32 Fe-56 Cu-64 Zn-65 一、单项选择题(48 分,每小题 3 分) 1.下列电池不属于化学电池的是( ) A. 铅蓄电池 B. 太阳能电池 C. 锌锰电池 D. 镍镉电池 2.常温下,用水稀释 0.1 mol·L-1 氨水时,溶液中随水量的增加而减小的是( ) A. c(OH-)/c(NH3·H2O) B. c(NH3·H2O)/c(OH-) C. c(H+)×c(OH-) D. n(OH-) 3.设 N A 为阿伏加徳罗常数的值,下列说法正确的是( ) A. pH=2 的醋酸稀释 10 倍后,溶液中 H+数目大于 0.001NA B. 室温下,pH=13 的氨水中,由水电离的 OH-浓度为 10-13mol/L C. 60℃时,1L 纯水中有 10-7N A 个 OH- D. 200mL 1mol/L Fe2(SO4)3 溶液中,Fe3+和 SO42-的离子总数是 NA 4.下列各组离子可能大量共存的是( ) A. 常温下水电离出的 c(H+)•c(OH-)=10-20 的溶液中:Na+、Cl-、S2-、SO32- B. 能与金属铝反应放出氢气的溶液中:Fe2+、NO3-、Cl-、NH4+ C. 可使石蕊试液变红的无色溶液中:Na+、CO32-、K+、ClO-、AlO2- D. 0.1mol/LFeCl3 溶液中:K+、NH4+、I-、SCN- 5.在常温下,将 pH=9 的 NaOH 溶液与 pH=11 的 NaOH 溶液等体积混合后,溶液的 pH 最 接 近于(已知 lg2=0.3)( ) A. 9.3 B. 9.7 C. 10 D. 10.7 6.有机酸种类繁多,甲酸( HCOOH)是常见的一元酸,常温下其 Ka=1.8×10-4,草酸(H2C2O4)是 常 见的二元酸,常温下,Ka1=5.4×10-2,Ka2=5.4×10-5。下列说法正确的是( ) A. 甲酸钠溶液中:c(Na+)>c(HCOOˉ)>c(H+)>c(OHˉ) B. 草酸氢钠溶液中加入甲酸钠溶液至中性:c(Na+)=c(HC2O4ˉ)+2c(C2O42-)+c(HCOOˉ) C. Na2C2O4 溶液中:c(HC2O4ˉ)+c(H2C2O4)+c(H+)=c(OHˉ) D. 足量甲酸与草酸钠溶液反应:2 HCOOH+Na2C2O4==H2C2O4+2 HCOONa 7.25℃时,往水中不断加入 NaHC2O4 固体,部分微粒浓度随加入的 c(HC2O4-)的变化趋势如 下 图所示。下列说法正确的是( ) A. 当 c(HC2O4-)=0.1mol/L 时, c (H+) > c (C2O42-)- c(H2C2O4) B. 当 c(HC2O4-)>amol/L 时,c (H+) < c(H2C2O4), HC2O4-的水解程度大于电离程度 C. HC2O4- C2O42-+H+,Ka(HC2O4-) =a D. 将 0.08mo1/L H2C2O4 溶液与等浓度 NaOH 溶液等体 积混合后(忽略体积变化), c(Na+) > c(HC2O4-)>c(C2O42-) > c(H2C2O4) > c(H+) >c(OH-) 8.常温下,向 20 mL 0.10 mol/L 甲胺的溶液中滴加 0.10 mol/L 盐酸时混合溶液的 pH 与相关 微粒 的浓度关系如图所示。已知:甲胺(CH3NH2)类似于氨,但碱性稍强于氨。下列说法不 正 确的是( ) A. 甲胺在水中的电离方程式 CH3NH2+H2O CH3NH3++OH- B. b 点对应的加入盐酸的体积小于 20mL C. 将等物质的量的 CH3NH2 和 CH3NH3Cl 一起溶于蒸馏 水,得到对应 a 点的溶液 D. 常温下,甲胺的电离常数为 Kb,则 pKb= - lgKb=3.4 9.室温时,体积为 1mL、浓度均为 0.1mol·L-1 的两种常见物质 X(OH)n、K2AO3 的溶液分別加水稀释至体积为 VmL,pH 随 lgV 的变化情况如下图所示。下列叙述错误的是( ) A.n=1 B.H2AO3 的二级电离常数 Ka2 约为 1.0×10-10.2 C.pH=10 的两种溶液中水的电离程度相同 D.升高温度,K2AO3 溶液 pH 增大,X(OH)n 溶液 pH 减小 10.下列说法中正确的是( ) A.将 H2S 通入 AgNO3 和 AgCl 的浊液中,观察到黑色沉淀,说明 Ksp(AgCl)> Ksp(Ag2S) B.Ksp 越小,难溶电解质在水中的溶解能力一定越弱 C.相同温度下,在水中和 NaCl 溶液中分别加入过量 AgCl 固体,所得溶液中 c(Ag+)相同 D.Ksp 的大小与离子浓度无关,只与难溶电解质的性质和温度有关 11.已知下表数据: 物质 Fe(OH)2 Cu(OH)2 Fe(OH)3 Ksp/25 ℃ 8.0×10-16 2.2×10-20 4.0×10-36 完全沉淀时的 pH 范围 ≥9.6 ≥6.4 ≥3 对含等物质的量的 CuSO4、FeSO4、Fe2(SO4)3 的混合溶液的下列说法,正确的是( ) A.向该混合溶液中逐滴加入 NaOH 溶液,最先看到的是蓝色沉淀 B.该溶液中 c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5∶4 C.向该溶液中加入适量氯水,调节 pH 到 4~5 后过滤,可获得纯净的 CuSO4 溶液 D.向该溶液中加入适量氨水,调节 pH 到 9.6 后过滤,将所得沉淀灼烧,可得等物质的 量 的 CuO、FeO、Fe2O3 三种固体的混合物 12.25℃时,Ksp[Mg(OH)2]=10-12,Ksp(MgF2)=10-10。下列说法正确的是( ) A.25℃时,在 Mg(OH)2 的悬浊液中加入少量的 NH4Cl 固体,c(Mg2+)减小 B.25℃时,饱和 Mg(OH)2 溶液与饱和 MgF2 溶液相比,前者的 c(Mg2+)大 C.25℃时,Mg(OH)2 固体在 20mL 0.01 mol•L-1 氨水中的 Ksp 比在 20mL 0.01 mol•L-1NH4Cl 溶液中的 Ksp 小 D.25℃时,欲用 1L NaF 溶液将 0.05mol Mg(OH)2 完全转化为 MgF2,则 c(NaF)≥1.1 mol•L-113.常温 下,用 AgNO3 溶液分别滴定浓度均为 0.01 mol•L-1 的 KCl、K2C2O4 溶液,所得的沉淀溶解平衡图像如 下图所示(不考虑 C2O42-的水解)。下列叙述正确的 是( ) A. Ksp(Ag2C2O4)的数量级等于 10-7 B. n 点表示 AgCl 的不饱和溶液 C. 向 c(Cl-)=c(C2O42-)的混合液中滴入 AgNO3 溶液时,先生成 Ag2C2O4 沉淀 D. Ag2C2O4+2C1-=2AgCl+C2O42-的平衡常数为 109.04 14.以熔融 Na2CO3 为电解质,H2 和 CO 混合气为燃料的电 池原理如图所示。下列说法正确的是( ) A.b 是电池的负极 B.该电池使用过程中需补充 Na2CO3 C.a、b 两级消耗气体的物质的量之比为 2:1 D.电极 a 上每消耗 22.4L 原料气体,电池中转移电子数约为 2NA 15.石墨烯锂硫电池放电时的工作原理示意图如图,电池反应为: 2Li + nS=Li2Sn,有关该电池说法正确的是( ) A.放电时,Li+ 向负极迁移 B.电池工作时,正极可发生反应:2Li2S6+2Li++2e-=3Li2S4 C.当外电路有 2mol 电子通过时,有 1mol Li+通过 阳离子交换膜 D.该电池可以选用盐酸作为电解质增强溶液导电性 16.一种钌(Ru)配合物光敏太阳能电池工作原理及电池中发生的反应如下所示。下列说法正确 的是( ) A. 电极 X 为电池的正极 B. 电池工作时,光能→化学能→电能 C. 电池工作时,I-在电极 Y 上得电子 D. 电池电解质溶液中 I-和 I3-的浓度不断减 少 二、填空题(52 分) 17.(8 分)按要求填空 (1)请将 Zn + 2Ag+ = 2Ag + Zn2+设计成双液 原电池,并画出简易装置图,并注明电极材 料以及电解质溶液 (2)书写甲醛-空气燃料电池(电解质溶液为 KOH)的负极电极反应式 。 3I− (3)氯铝电池是一种新型的燃料电池,电解质溶液是 KOH 溶液,请写出电子流出的电极的 电极反应式为: 。 (4)酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是有碳粉,二氧 化 锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生 MnOOH,该电池反应的 离 子方程式为 。 18.(14 分)葡萄酒中抗氧化剂的残留量是以游离 SO2 的含量计算,我国国家标准(GB2760- 2014)规定葡萄酒中 SO2 的残留量≤0. 25g/L。某兴趣小组用图 1 装置(夹持装置略)收 集某 葡萄酒中的 SO2,并对含量进行测定。实验步骤如下 图 1 图 2 i. 检查装置的气密性后,向图 1 仪器 A 中加入 300.00ml 葡萄酒和适量盐酸 ii. 加热使 SO2 全部逸出并与 B 中 H2O2 完全反应 iii. 除去 B 中过量的 H2O2 后,将 B 中溶液取出,稀释至 100mL iv.取 25.00mL 稀释后的溶液至于锥形瓶中,加入几滴酚酞 v.用 0.0300mol/L NaOH 标准溶液进行滴定,重复三次 (1)SO2 在水中可形成 SO2 ─饱和 H2SO3 溶液体系,此体系中存在多个含硫元素的平衡,分 别 用化学方程式表示为_______________。 (2)图 2 中①中仪器名称为_____________,步骤 v 中,滴定前排气泡时,应选择图 2 中的 ___。 (3)除去过量 H2O2 的方法是_________________。 (4)滴定的终点现象 ;若用 50 mL 滴定管进行实 验,当滴定管中的液面在刻度“10”处,则管内液体的体积 (填序号)___________(①=10 mL, ②=40 mL,③<10 mL,④>40 mL)。 (5)滴定消耗的 NaOH 溶液的体积如下,则该葡萄酒中 SO2 含量为____g/L。 滴定次数 1 2 3 NaOH 溶液体积/mL 21.80 20.02 19.98 (6)某同学认为该测定结果不能说明该葡萄酒中 SO2 残留量一定超标。原因是__________。 利 用 现 有 装 置 可 以 如 何 改 进 ? _____________ 。 19.(15 分)某火电厂收捕到的粉煤灰的主要成分为 SiO2、Al2O3、FeO、Fe2O3、MgO、TiO2 等。研究小组对其进行综合处理的流程如下: 已知:①“酸浸”后钛主要以 TiOSO4 形式存在,强电解质 TiOSO4 在溶液中仅能电离 SO42- 和一种阳离子 ②常温下,Ksp[Al(OH)3]=1.0×10-34,Ksp[Fe(OH)3]=4.0×10-38,Ksp[Mg(OH)2]= 5.61×10-12 ③滤液 1 中仍有 Fe2+剩余 请回答下列问题: (1)为了提高粉煤灰浸出速率,在“酸浸”时可采取的措施有_______________________ (2)“水解”反应的离子方程式为______________________________________。 怎样判断 TiO2•xH2O 沉淀已经洗涤干净____________________________________________。 (3)加入双氧水调节溶液 pH 时离子方程式为_______________________________________。 滤渣 2 成分为________________。为使滤渣 2 沉淀完全(溶液中离子浓度小于 10-5mol/L)。 需“调 pH”为________。(保留两位有效数字) (4)滤液 3 在蒸发结晶制备 MgCl2•6H2O 应注意_____________________________________。 ( 5 ) “ 结 晶 ” 需 控 制 在 70 ℃ 左 右 , 温 度 过 高 的 后 果 会 导 致 的 后 果 为 ________________________。 20.(15 分)氮的化合物应用广泛,但氮氧化物是重要的空气污染物,应降低其排放。 (1)用 CO2 和 NH3 可合成氮肥尿素[CO(NH3)2] 已知:①2NH3(g)+CO2(g)=NH2CO2NH4 (s) △H=-159.5 kJ·mol-1 ②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1 ③H2O(l)=H2O(g) △H=+44 kJ·mol-1 用 CO2 和 NH3 合成尿素(副产物是液态水)的热化学方程式为______________。 (2)工业上常用如下反应消除氮氧化物的污染: CH4(g)+2NO2(g) N2(g)+CO2(g)+2H2O(g) △H 在温度为 T1 和 T2 时,分别将 0.40molCH4 和 1.0molNO2 充入体积为 1L 的密闭容器中,n(CH4) 随反应时间的变化如右图所示: ①根据右图判断该反应的△H______0(填“>”、“<”或“=”)。 ②温度为 T1 时,0~10min 内 NO2 的平均反应速率 v(NO2)=__________,反应的平衡常 数 K=___(保留三位小数) ③该反应达到平衡后,为在提高反应速率同时提高 NO2 的转化率,可采取的措施有______ (填标号)。 A.改用高效催化剂 B.升高温度 C.缩小容器的体积 D.增加 CH4 的浓度 (3)利用原电池反应可实现 NO2 的无害化,总反应为 6NO2+8NH3=7N2+12H2O,电解质溶液 为 NaOH 溶液,工作一段时间后,该电池正极区附近溶液 pH________(填“增大”、“减小” 或“不变”),负极的电极反应式为___________________。 (4)氮的一种氢化物 HN3,其水溶液酸性与醋酸相似,则 NaN3 溶液中各离子浓度由大到小 的顺序为________;常温下,将 amol·L-1 的 HN3 与 bmol·L-1 的 Ba(OH) 2 溶液等体积混合, 充分反应后,溶液中存在 2c(Ba2+)=c(N3-),则该混合物溶液呈_______(填“酸”、“碱”或 “中”)性,溶液中 c(HN3)=_________ mol·L-1。 答案 题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 答案 B B B A D B A C C D B D D C B B 17(8 分)(1)略(2 分) (2)HCHO-4e-+6OH-===CO2-3 +4H2O(2) (3)Al-3e-+4OH-===AlO-2 +2H2O(2 分) (4)Zn+2MnO2+2H+=Zn2++2MnOOH 或 Zn+2MnO2+2NH4+=Zn2++2MnOOH+2NH3 (2) 18(14 分) (1)SO2(g) SO2 (aq);SO2+H2O H2SO3;H2SO3 H+ + HSO3-; HSO3- H+ + SO32-(3 分,写对三个即满分,每个方程式 1 分) (2)酸式滴定管(1 分);③(1 分) (3)加入二氧化锰并振荡(2 分) (4)滴入最后一滴溶液,锥形瓶溶液由无色变为浅红色且半分钟不褪色(2);④(1 分) (5)0.2560;(2 分) (6)原因:可能有盐酸挥发进入 B 瓶中(1 分);改进措施:用蒸馏水代替葡萄酒进行对比实 验或用不挥发的强酸如硫酸代替盐酸,排除盐酸挥发的影响(1 分) 19 (15 分) (1)适当升高温度,增大硫酸的浓度,将粉煤灰研成粉末或搅拌等(1 分) (2)TiO2++(x+1)H2O=TiO2·xH2O+2H+ (2 分) 取最后一次洗涤液,加入氯化钡溶液,没有白色沉淀生成,则洗干净(2 分) (3)2Fe2++H2O2+2H+ = 2Fe3++2H2O(2 分) Al(OH)3 Fe(OH)3 (2 分,各 1 分,写错一个扣 1 分) 4.3 (2 分) (4)在不断通入 HC1(或者加入盐酸),不断搅拌并且不能蒸干(2 分) (5)TiO2+离子提前水解(2 分) 20(15 分) (1)2NH3(g) +CO2(g)=CO(NH2)2(s)+ H2O (l) △H=-87kJ/mol (2 分) (2)① <(1 分) ②0.02 mol ·L-1·min-1(1 分) 2.03(2 分) ③D (1 分) (3)增大(1) 2NH3-6e-+6OH-=N2 + 6H2O(2 分) (4)c(Na+)>c(N3﹣)>c(OH-)>c(H+)(2 分) 中(1 分) (0.5a-b)(2 分)查看更多