- 2021-07-02 发布 |
- 37.5 KB |
- 12页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
黑龙江省安达七中2020届高三上学期寒假考试(4)化学试卷
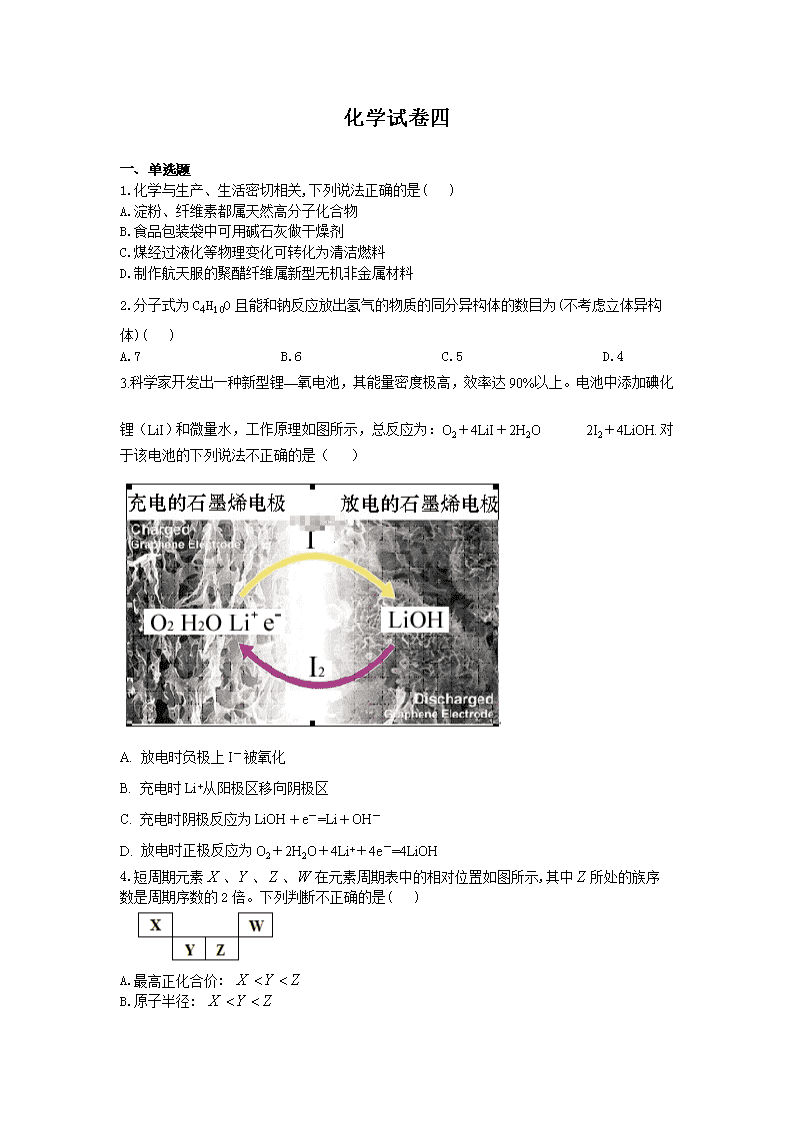
化学试卷四 一、单选题 1.化学与生产、生活密切相关,下列说法正确的是( ) A.淀粉、纤维素都属天然高分子化合物 B.食品包装袋中可用碱石灰做干燥剂 C.煤经过液化等物理变化可转化为清洁燃料 D.制作航天服的聚醋纤维属新型无机非金属材料 2.分子式为C4H10O且能和钠反应放出氢气的物质的同分异构体的数目为(不考虑立体异构体)( ) A.7 B.6 C.5 D.4 3.科学家开发出一种新型锂—氧电池,其能量密度极高,效率达90%以上。电池中添加碘化锂(LiI)和微量水,工作原理如图所示,总反应为:O2+4LiI+2H2O充电 放电 2I2+4LiOH.对于该电池的下列说法不正确的是( ) A. 放电时负极上I- 被氧化 B. 充电时Li+从阳极区移向阴极区 C. 充电时阴极反应为LiOH+e-=Li+OH- D. 放电时正极反应为O2+2H2O+4Li++4e-=4LiOH 4.短周期元素、、、在元素周期表中的相对位置如图所示,其中所处的族序数是周期序数的2倍。下列判断不正确的是( ) A.最高正化合价: B.原子半径: C.气态氢化物的热稳定性: D.最高价氧化物对应水化物的酸性: 5.下列实验操作、现象和结论均正确的是( ) 选项 实验操作 现象 结论 A 将0.1mol·L-1MgSO4溶液滴入NaOH 溶液至不再有沉淀产生,再滴加0.1 mol·L-1CuSO4溶液 先有白色沉淀生 成后变为蓝色沉淀 Cu(OH)2的Ksp比 Mg(OH)2的小 B 用洁净铂丝蘸取溶液进行焰色反应 火焰呈黄色 原溶液中有Na+,无K+ C 向盛Na2SiO3溶液的试管中滴加1滴酚酞, 然后逐滴加入稀盐酸至红色褪去 2min后,试管里出现凝胶 非金属性:Cl>Si D 向蔗糖中加入浓硫酸 蔗糖变成疏松多孔的海 绵状碳 浓硫酸具有吸水性和 强氧化性 A.A B.B C.C D.D 6.已知:含碳碳双键的物质一定条件下能与水发生加成反应生成醇,有机物—间存在图示的转化关系。下列说法不正确的是( ) A. 能使酸性高锰酸钾溶液褪色 B.可用萃取碘水中的碘单质 C. 与乙酸发生了取代反应 D. 的结构简式为 7.在常温下,用的盐酸滴定溶液,所得滴定曲线如下图所示。下列微粒浓度间的关系不正确的是( ) A.a点: B.b点: C.c点: D.d点: 二、填空题 8.为了预防碘缺乏症,国家规定每千克食盐中应含有40~50mg碘酸钾。碘酸钾晶体具有较高的稳定性,但在酸性溶液中,碘酸钾是一种较强的氧化剂,能跟某些还原剂反应生成碘;在碱性溶液中,碘酸钾能被氯气、次氯酸等更强的氧化剂氧化为更高价的碘的含氧酸盐。工业生产碘酸钾的流程如图所示。 1.碘在周期表中的位置为__________; 2.碘、氯酸钾、水混合反应时,若两种还原产物所得电子的数目相同,请配平该反应的化学方程式:____I2+____KClO3+____H2O=____KH(IO3)2+____KCl+____Cl2↑; 3.混合反应后,用稀酸酸化的作用是__________,在稀盐酸和稀硝酸中不能选用的酸是__________,理由是__________; 4.试剂X的化学式为__________,写出用试剂X调pH的化学方程式__________________; 5.如果省略“酸化”、“逐氯”、“结晶①、过滤”这三步操作,直接用试剂X调整反应混合物的pH,对生产碘酸钾有什么影响?________________________________________。 9.氨在生活、生产、科研中有广泛用途。 1.已知反应Ⅰ:2NH3(g) +CO2(g) NH2CO2NH4(s) △H=−159.5kJ/mol 反应Ⅱ:NH2CO2NH4(s) CO(NH2)2(s)+H2O(g) △H=+116.5kJ/mol 反应Ⅲ:H2O(l) H2O(g) △H=+44.0kJ/mol 则工业上以CO2、NH3为原料合成尿素和液态水的热化学方程式为___________________,该反应在____________条件下可以自发进行(填“高温”、“低温”或“任何温度下”); 2.用NH3催化还原NxOy可以消除氮氧化物的污染。如有反应 4NH3(g)+6NO(g)5N2(g)+6H2O(l) △H<0,相同条件下在2L密闭容器内,选用不同的催化剂,反应产生N2的量随时间变化如图所示。 ①0~4分钟在A催化剂作用下,反应速率v(N2)=_______________; ②下列说法正确的是____________; A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C) B.使用催化剂A达平衡时,N2最终产率更大 C.单位时间内氢氧键与氮氢键断裂的数目相等时,说明反应已经达到平衡 D.若在恒容绝热的密闭容器中发生反应,当平衡常数不变时,说明反应已经达到平衡 3.查阅资料可知:常温下,K稳[]=1.00×107,Ksp[AgCl]=2.50×10-10。 ①银氨溶液中存在平衡:Ag+(aq)+2NH3(aq) (aq),该反应平衡常数的表达式为 K稳=______________________; ②计算得到可逆反应AgCl(s)+2NH3(aq) (aq)+Cl-(aq)的化学平衡常数 K=_________,1L1mol/L氨水中最多可以溶解AgCl________mol(保留2位有效数字); 4.工业上以氨、丙烯和空气为原料,一定条件下合成丙烯腈(CH2CH—CN),该反应的化学方程式为___________。 10.硝酸铵可用作化肥、军用炸药、杀虫剂、冷冻剂等,工业制取硝酸铵的工艺流程如下: 1.合成氨气的工业设备名称是__________,设备中设置热交换器的目的是__________, 合成氨的原料气必须先脱硫,目的是__________; 2.吸收塔中反应的化学方程式为___________________,从生产流程看,吸收塔中需要补充空气,其原因是__________________________; 3.生产硝酸的过程中常会产生氮的氧化物,可用如下三种方法处理: 方法一:碱性溶液吸收法 NO+NO2+2NaOH 2NaNO2+H2O;2NO2+Na2CO3 NaNO2+NaNO3+CO2 方法二:NH3还原法 8NH3(g)+6NO2(g) 7N2(g)+12H2O(g) △H=-2635kJ/mol(NO也有类似的反应) 方法三:甲烷吸收法 CH4(g)+2NO2 CO2(g)+N2+2H2O(g) △H=+867kJ/mol(NO也有类似的反应) 上述三种方法中,方法一的主要缺点是__________; 方法三和方法二相比,方法三的缺点是__________; 4.工业上也可以通过电解NO制备NH4NO3,其工作原理如下图所示。 ①图中通入NH3的目的是_____________; ②若维持电流强度为3A,电解2小时,理论上可制得NH4NO3的最大质量为_________g;(已知F=96500C·mol-1)(保留2位有效数字)。 5.某化肥厂用NH3制备NH4NO3。己知:NH3制NO的产率是94%,NO制HNO3的产率是89%,则制HNO3所用NH3的质量占总耗NH3质量(不考虑其他损耗)的百分比为__________。 11.80%左右的非金属元素在现代技术包括能源、功能材料等领域占有极为重要的地位。 1.氮及其化合物与人类生产、生活息息相关,基态N原子中电子在2p轨道上的排布遵循的原则是________,N2F2分子中N原子的杂化方式是____________,1molN2F2含有______个σ键。 2.高温陶瓷材料Si3N4晶体中键角N—Si—N________Si—N—Si(填“>”“<”或“=”),原因是_________。 12.金属元素在现代工业中也占据极其重要的地位,钛被称为“未来的钢铁”,具有质轻,抗腐蚀,硬度大特点,是理想化工设备材料。 1.基态钛原子核外共有__________种运动状态不相同的电子。金属钛晶胞如图1所示,为__________堆积(填堆积方式)。 2.纳米TiO2是一种应用广泛的催化剂,其催化的一个实例如图2。化合物乙的沸点明显高于化合物甲,主要原因是__________。化合物乙中采取sp3杂化的原子的电负性由大到小的顺序为__________。 3.钙钛矿晶体的结构如图3所示。假设把氧离子看做硬球接触模型,钙离子和钛离子填充氧离子的空隙,氧离子形成正八面体,钛离子位于正八面体中心,则一个钛离子被__________个氧离子包围。 三、推断题 13.化合物M是二苯乙炔类液晶材料的一种,最简单的二苯乙炔类化合物是 ,以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下: 回答下列问题: 1.A的名称为__________; 2.D的结构简式是__________________,分子中最多有_________个碳原子共平面,F结构中的官能团名称是____________________; 3.①的反应方程式是_______________________________________,④的反应类型是_______; 4.关于物质C的下列说法正确的是___________________; A.遇三氯化铁发生显色反应 B.能够被氧化成醛类物质 C.其一氯代有机产物两种 D.一定条件下能够和氢溴酸发生反应 5.B满足苯环上有两个取代基且能发生银镜反应的同分异构体共有____种(不考虑立体异构),其中核磁共振氢谱为5组峰,且峰面积比为6:2:2:1:1的是_________(写结构简式); 6.参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备 的合成路线________________________________________________。 四、实验题 14.NaCN为剧毒无机物。某兴趣小组查资料得知,实验室里的NaCN溶液可使用Na2S2O3溶液进行解毒销毁,他们开展了以下三个实验,请根据要求回答问题: 1.实验Ⅰ.硫代硫酸钠晶体(Na2S2O3·5H2O)的制备: 已知Na2S2O3·5H2O对热不稳定,超过48℃即开始丢失结晶水。现以Na2CO3和Na2S物质的量之比为2:1的混合溶液及SO2气体为原料,采用如图装置制备Na2S2O3·5H2O。 (1)将Na2S和Na2CO3按反应要求的比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在蒸馏烧瓶中加入Na2SO3固体,在分液漏斗中注入____________(填以下选择项的字母),并按下图安装好装置,进行反应。 A.稀盐酸 B.浓盐酸 C.70%的硫酸 D.稀硝酸 (2)pH小于7会引起Na2S2O3 溶液的变质反应,会出现淡黄色混浊。反应约半小时,当溶液pH接近或不小于7时,即可停止通气和加热。如果通入SO2过量,发生的化学反应方程式为_________________________; (3)从上述生成物混合液中获得较高产率Na2S2O3·5H2O的歩骤为 为减少产品的损失,操作①为趁热过滤,其目的是______________________________; 操作②是___________________________________;操作③是抽滤、洗涤、干燥。 2.实验Ⅱ.产品纯度的检测: (4)已知:Na2S2O3·5H2O的摩尔质量为248g/mol;2Na2S2O3+I2 2NaI+Na2S4O6。取晶体样品ag,加水溶解后,滴入几滴淀粉溶液,用0.010mol/L碘水滴定到终点时,消耗碘水溶液vmL,则该样品纯度是______________________; (5)滴定过程中可能造成实验结果偏低的是___________________; A.锥形瓶未用Na2S2O3溶液润洗 B.锥形瓶中溶液变蓝后立刻停止滴定,进行读数 C.滴定终点时仰视读数 D.滴定管尖嘴内滴定前无气泡,滴定终点发现气泡 3.实验Ⅲ.有毒废水的处理: (6)兴趣小组的同学在采取系列防护措施及老师的指导下进行以下实验: 向装有2mL0.1mol/L的NaCN溶液的试管中滴加2mL0.1mol/L的Na2S2O3溶液,两反应物恰好完全反应,但无明显现象,取反应后的溶液少许滴入盛有10mL0.1mol/LFeCl3溶液的小烧杯,溶液呈现血红色,请写出Na2S2O3解毒的离子反应方程式____________________。 参考答案 1.答案:A 解析: 2.答案:D 解析: 3.答案:C 解析:A、放电时,负极上发生失电子的氧化反应,元素的化合价升高,根据总反应,得到I- 被氧化,故A正确; B、充电时,电解质里的阳离子移向阴极,故B正确; C、充电时阴极发生得电子的还原反应,应该是碘单质得电子的还原反应,故C错误; D、放电时,正极上发生得电子的还原反应,正极反应为O2+2H2O+4Li++4e-═4LiOH,故D正确. 故选C. 4.答案:B 解析: 5.答案:A 解析: 6.答案:B 解析: 7.答案:B 解析:A. a点n(HCl)=0.1000mol/L×0.0125L=0.00125mol,n(Na2CO3)=0.1000mol/L×0.025L=0.0025mol,反应生成0.00125molNaCl和NaHCO3,剩余0.00125molNa2CO3,碳酸根离子水解程度大于碳酸氢根离子,所以c()查看更多