- 2021-07-02 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020高考化学冲刺600分“7+3”小卷信息练一含解析
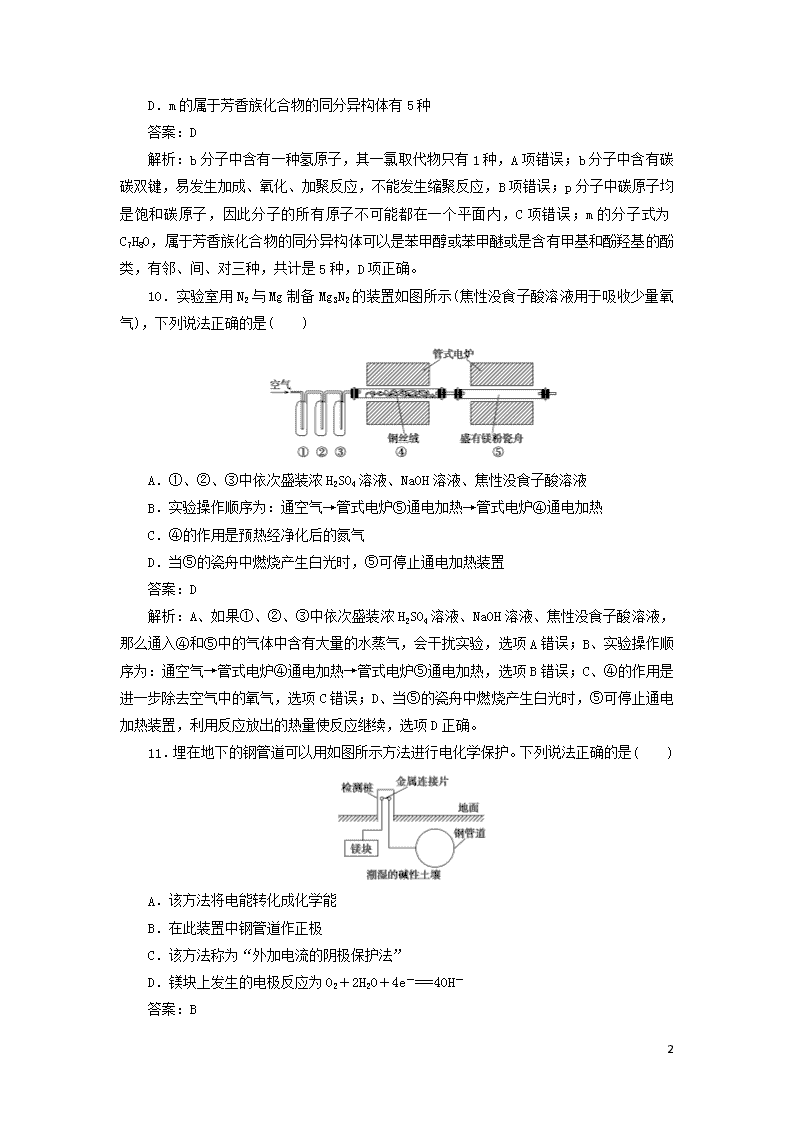
“7+3”小卷信息练(一) 1.本试卷分为选择题和非选择题两部分。满分85分,考试时间45分钟。 2.可能用到的相对原子质量:H—1 Li—7 C—12 N—14 O—16 Na—23 S—32 Cl—35.5 K—39 Fe—56 Cu—64 Zn—65 一、选择题(本题共7小题,每小题6分。在每小题给出的四个选项中,只有一项是符合题目要求的。) 7.《天工开物》中记载了砒霜(As2O3)的制取:“凡烧砒,下鞠(注:在地上挖砌)土窑,纳石其上,上砌曲突(注:烟筒),以铁釜倒悬覆突口。其下灼炭举火。其烟气从曲突内熏贴釜上。”文中涉及的操作为( ) A.蒸馏 B.升华 C.干馏 D.萃取 答案:B 解析:升华利用固体受热直接转化成气体,遇冷重新转化成固体,属于物理变化,根据题意,“凡烧砒……烟气从曲突内熏贴釜上”,符合升华原理,B项正确。 8.阿伏加德罗常数的值用NA表示,下列叙述正确的是( ) A.室温时,1 L pH=2的NH4Cl溶液中H+的数目为1×10-12 NA B.1 mol LiAlH4在125 ℃完全分解成LiH、H2、Al,转移电子数为3NA C.1.7 g氨气中含有共价键的数目为0.4NA D.标准状况下,22.4 L NO2含有的原子数小于3NA 答案:B 解析:pH=2的NH4Cl溶液中,c(H+)=0.01 mol·L-1,则1 L溶液中H+的数目为1×10-2 NA,A项错误;根据氧化还原反应电子转移的计算,1 mol LiAlH4含1 mol Al,Al元素化合价降低3价,转移电子数为3NA,B项正确;1个氨分子含有三个共价键,1.7 g氨气中含有共价键的数目为0.3NA,C项错误;标准状况下,NO2将变为液态的N2O4,不能用气体摩尔体积进行计算,D项错误。 9.环丙叉环丙烷(b)由于其特殊的电子结构,一直受到结构和理论化学家的注意。根据其转化关系,判断下列说法正确的是( ) A.b的一氯取代物只有2种 B.b易发生加成、氧化、缩聚反应 C.p的所有原子都在一个平面内 8 D.m的属于芳香族化合物的同分异构体有5种 答案:D 解析:b分子中含有一种氢原子,其一氯取代物只有1种,A项错误;b分子中含有碳碳双键,易发生加成、氧化、加聚反应,不能发生缩聚反应,B项错误;p分子中碳原子均是饱和碳原子,因此分子的所有原子不可能都在一个平面内,C项错误;m的分子式为C7H8O,属于芳香族化合物的同分异构体可以是苯甲醇或苯甲醚或是含有甲基和酚羟基的酚类,有邻、间、对三种,共计是5种,D项正确。 10.实验室用N2与Mg制备Mg3N2的装置如图所示(焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是( ) A.①、②、③中依次盛装浓H2SO4溶液、NaOH溶液、焦性没食子酸溶液 B.实验操作顺序为:通空气→管式电炉⑤通电加热→管式电炉④通电加热 C.④的作用是预热经净化后的氮气 D.当⑤的瓷舟中燃烧产生白光时,⑤可停止通电加热装置 答案:D 解析:A、如果①、②、③中依次盛装浓H2SO4溶液、NaOH溶液、焦性没食子酸溶液,那么通入④和⑤中的气体中含有大量的水蒸气,会干扰实验,选项A错误;B、实验操作顺序为:通空气→管式电炉④通电加热→管式电炉⑤通电加热,选项B错误;C、④的作用是进一步除去空气中的氧气,选项C错误;D、当⑤的瓷舟中燃烧产生白光时,⑤可停止通电加热装置,利用反应放出的热量使反应继续,选项D正确。 11.埋在地下的钢管道可以用如图所示方法进行电化学保护。下列说法正确的是( ) A.该方法将电能转化成化学能 B.在此装置中钢管道作正极 C.该方法称为“外加电流的阴极保护法” D.镁块上发生的电极反应为O2+2H2O+4e-===4OH- 答案:B 8 解析:A.构成的原电池中,该方法是将化学能转化成了电能,A项错误;B.根据图片知,该金属防护措施采用的是牺牲阳极的阴极保护法,钢管道作正极,B项正确;C.根据图片知,该金属防护措施采用的是牺牲阳极的阴极保护法,C项错误;D.镁块作负极,电极反应:Mg-2e-+2OH-===Mg(OH)2↓,D项错误。 12.W、X、Y、Z是四种短周期非金属元素,原子序数依次增大。X、Y原子核外L电子层的电子数之比为3:4,X与Z为同主族元素,且X、Y、Z的最外层电子数之和为16,W的简单离子W-能与水反应生成单质W2。下列说法正确的是( ) A.单质熔点:Z>Y B.W与X形成的化合物中只含有极性键 C.最高价氧化物对应水化物的酸性:Z>Y D.气态氢化物的热稳定性:Z>X 答案:C 解析:根据X、Y原子核外L电子层的电子数之比为3:4知,X的L层可以为3或6,即X为B或O,X与Z为同主族元素,若X为B,则Z为Al,为金属元素,不符合题意,故X为O,Z为S;根据X、Y、Z的最外层电子数之和为16,而X(O)、Z(S)的最外层电子数均为6,则Y的最外层电子数为4,故Y为Si。W-能与H2O反应生成单质W2,则W为H。S为分子晶体,Si为原子晶体,故单质熔点:S查看更多