- 2021-07-02 发布 |
- 37.5 KB |
- 9页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2018届河北省承德二中高二下学期第三次月考(2017
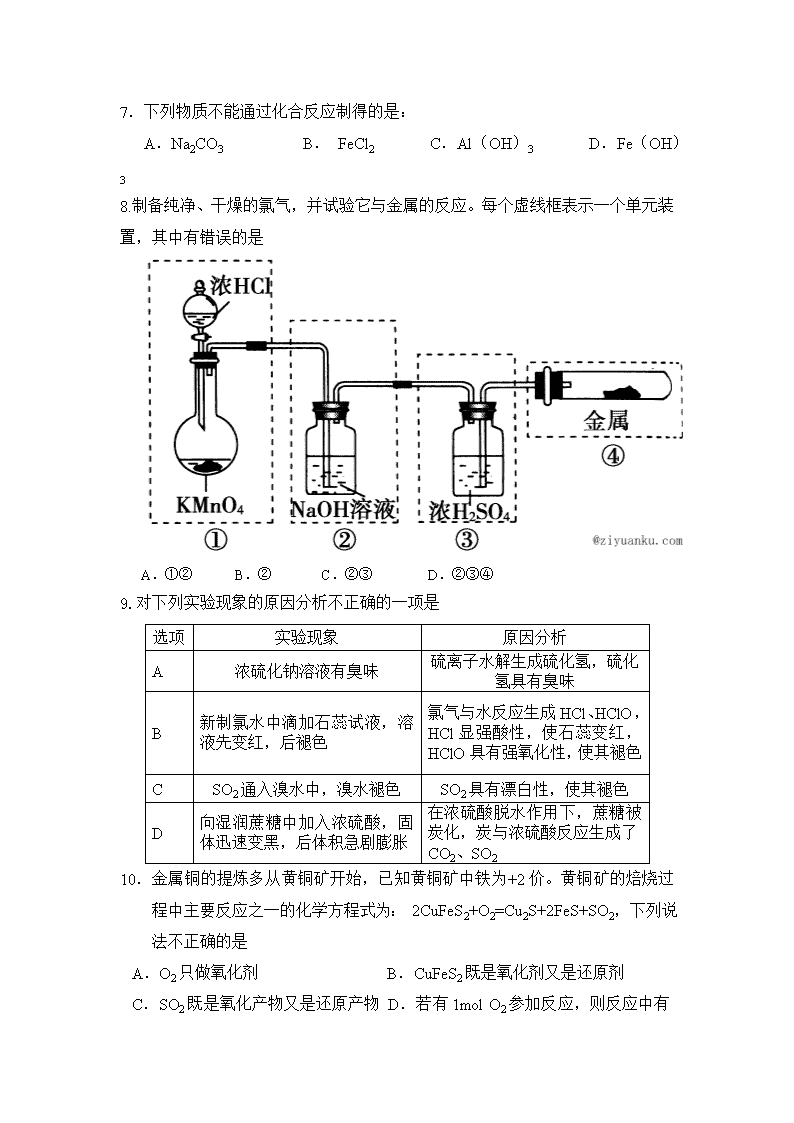
高二化学月考试题 本试卷分第I卷(选择题)和第II卷(非选择题)两部分,包括29小题。共100分。 第I卷(选择题共50分) 一.选择题(本题包括25小题,每小题2分,共50分,每小题只有一个选项符合题意。) 1、随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品氧化变质,在包装袋中可以放入的化学物质是 A.无水硫酸铜 B.硫酸亚铁 C. 食盐 D. 生石灰 2.下列说法正确的是 A.硅材料广泛应用于光纤通讯 B.工艺师利用盐酸刻蚀石英制作艺术品 C.水晶项链和餐桌上的瓷盘都是硅酸盐制品 D.粗硅制备单晶硅不涉及氧化还原反应 3.下列离子方程式书写正确的是 A.铝粉投入到NaOH溶液中:2Al+2OH-═ 2AlO2-+H2↑ B.AlCl3溶液中加入足量的氨水:Al3++ 3OH- ═ Al(OH)3↓ C.三氯化铁溶液中加入铁粉: D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl- 4.有一种常见氮肥,加热可完全分解为气体,其中一种气体能使湿润的红色石蕊试纸变蓝,另一种气体能使澄清石灰水变浑浊。取少量该氮肥溶于水,并加入少量CaCl2溶液,无明显现象。由此可知该氮肥的主要成分是 A.NH4Cl B.NH4HCO3 C.NH4NO3 D.(NH4)2CO3 5.现有下列试剂:①氯水 ②Br2水 ③碘水 ④O3 ⑤NO2 ⑥稀硝酸,其中能使淀粉碘化钾溶液变蓝的是 A.①②⑥ B.④⑤ C.除③外 D.全部 6.为了除去镀在铝制品表面的铜镀层,可选用的试剂是 A.稀硝酸 B.浓硝酸 C.浓硫酸 D.浓盐酸 7.下列物质不能通过化合反应制得的是: A.Na2CO3 B. FeCl2 C.Al(OH)3 D.Fe(OH)3 8.制备纯净、干燥的氯气,并试验它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是 A.①② B.② C.②③ D.②③④ 9.对下列实验现象的原因分析不正确的一项是 选项 实验现象 原因分析 A 浓硫化钠溶液有臭味 硫离子水解生成硫化氢,硫化氢具有臭味 B 新制氯水中滴加石蕊试液,溶液先变红,后褪色 氯气与水反应生成HCl、HClO,HCl显强酸性,使石蕊变红,HClO具有强氧化性,使其褪色 C SO2通入溴水中,溴水褪色 SO2具有漂白性,使其褪色 D 向湿润蔗糖中加入浓硫酸,固体迅速变黑,后体积急剧膨胀 在浓硫酸脱水作用下,蔗糖被炭化,炭与浓硫酸反应生成了CO2、SO2 10.金属铜的提炼多从黄铜矿开始,已知黄铜矿中铁为+2价。黄铜矿的焙烧过程中主要反应之一的化学方程式为: 2CuFeS2+O2=Cu2S+2FeS+SO2,下列说法不正确的是 A.O2只做氧化剂 B.CuFeS2既是氧化剂又是还原剂 C.SO2既是氧化产物又是还原产物 D.若有1mol O2 参加反应,则反应中有4mol电子转移 11.0.03molCu投入到一定量的浓HNO3中,Cu完全溶解,生成气体颜色越来越浅,共收集到标准状况下672mL气体,将盛有此气体的容器倒扣在水槽中,通入标准状况下一定体积的O2,恰好使气体完全溶于水,则通入O2的体积为 A.504mL B.336mL C.224mL D.168mL 12.下列各组物质中,不能按 (“→”表示一步完成)关系转化的是 选项 A B C D a NaOH HNO3 HCl S b Na2CO3 NO Cl2 SO3 c NaCl NO2 HClO H2SO4 13.某炼金厂的废水因连降暴雨而溢出,导致河水严重污染,炼金废水中所含CN-有剧毒, 其性质与卤素离子相似,还原性介于I-与Br-之间,HCN为弱酸.下列说法不正确的是 A.CN-可以和稀硫酸反应生成HCN B.CN-可被Cl2氧化成(CN)2 C.在水溶液中(CN)2不能将F-氧化 D.HCN的电子式为HN⋮⋮C 14.工业废气中氮氧化物是主要污染物,为了治理污染,常通入NH3,发生反应NOx+NH3 ―→N2+H2O来治理污染.现有NO、NO2的混合气体3 L,用同温同压下3.5 LNH3使其 恰好完全转化为N2,则混合气体中NO、NO2的物质的量之比为 A.1∶1 B.2∶1 C.1∶3 D.1∶4 15.某溶液中可能存在Br-、CO、SO、Al3+、I-、Mg2+、Na+7种离子中的几种.现取 该溶液进行实验,得到如下现象:①向溶液中滴加足量氯水后,溶液变橙色,且有无色 气体冒出;②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;③向所得溶液中继 续滴加淀粉溶液,溶液不变蓝色。据此可以推断:该溶液中肯定不存在的离子是 A.Al3+、Na+、SO、I- B.Mg2+、Na+、CO、Br- C.Al3+、Mg2+、I-、SO D.Al3+、CO、Br-、SO 16.下列系统命名法正确的是 A.1,2二甲基戊烷 B.3,4,4三甲基己烷 C.3甲基己烷 D.新戊烷 17.某有机物的结构简式为: 其正确的命名为 A. 2,3—二甲基—3—乙基丁烷 B2,3—二甲基—2—乙基丁烷 C. 2,3,3—三甲基戊烷 D3,3,4—三甲基戊烷 18.北京奥运会期间对大量盆栽鲜花施用了S诱抗素制剂,以保持鲜花盛 开。S诱抗素的分子结构如图,下列关于该分子说法正确的是 A.含有碳碳双键、苯环、羟基、羰基 B.含有苯环、羟基、羰基、羧基 C.含有羟基、羰基、羧基、酯基 D.含有碳碳双键、羟基、羰基、羧基 19. 下列描述CH3-CH=CH-CH=CH2分子结构的叙述中,正确的是 A.5个碳原子有可能都在同一条直线上 B.5个碳原子有可能都在同一平面上 C.5个碳原子不可能都在同一平面上 D.不能判断是否可能都在同一平面上或同一条直线上 20.下列物质在催化剂作用下和氢气加成不能得到2甲基戊烷的是 A.CH3CH=C(CH3)CH2CH3 B.CH3CH=CHCH(CH3)2 C.(CH3)2C=CHCH2CH3 D.HC三CCH2CH(CH3)2 21.某烷烃的一个分子里含有9个碳原子,其一氯代物只有两种,该烷烃的名称是 A.正壬烷 B.2,6二甲基庚烷 C.2,2,4,4四甲基戊烷 D.2,3,4三甲基己烷 22.萘环上的碳原子编号如Ⅰ式,根据系统命名法,Ⅱ式可称为2硝基萘,则化合物Ⅲ的名称应是 A.2,6二甲基萘 B.2,5二甲基萘 C.4,7二甲基萘 D.1,6二甲基萘 23.下列系统命名法正确的是( ) A 2甲基3丁醇 B 二溴乙烷 C 3乙基1丁烯 D 2甲基2,4己二烯 24.菲与蒽互为同分异构体,菲分子的结构简式为,从菲的结构简式分析,菲的一氯取代物有 A.4种 B.5种 C.10种 D.14种 25. 已知化合物B3N3H6(硼氮苯)与C6H6(苯)的分子结构相似,如下图:则硼氮苯的二氯取代物 B3N3H4CI2 的同分异构体的数目为 A.2 B. 3 C. 4 D. 6 第II卷(非选择题共50分) 26(12分)某无色溶液可能由、、、、、、、、 中的若干种组成。为了确定该溶液的成分, 进行如下实验: ① 取少量该溶液加入过量稀盐酸,有气体生成,得到甲溶液; ② 取少量甲溶液,向其中加入硝酸酸化的硝酸银溶液,出现白色沉淀甲; ③ 取少量原溶液,向其中加人Ba(OH)2溶液,出现白色沉淀乙。 根据上述实验回答下列问题: (1)溶液中一定不存在的离子是___________________ (2)—定存在的离子是______________________ (3)沉淀乙中一定含有_______________________ ,可能含有________________________ 判断乙成分的方法是_________________________________________________________ 有关反应的离子方程式__________________________________________________________ 27(12分)某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化: 据此回答下列问题: (1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是 。 (2)根据上述框图反应关系,写出下列B、D、E所含物质的化学式 B ;D ;E 。 (3)写出①、③反应方程式① ③ ; 28(16分)某同学设计实验证明铜与浓硫酸能发生反应,并检验生成气体的性质,如图所示,在试管里加入2mL浓硫酸,用带导管和一个小孔的胶管塞紧,从孔中插入一根铜丝,加热,把放出的气体依次通入品红溶液和石蕊溶液中。 请回答下列问题: (1)写出铜与浓硫酸反应的化学方程式: 。 (2)试管a、b分别检验生成气体的性质,写出观察到的现象及其作用。 试管a中的现象 , 作用是 。 试管b中的现象是 , 作用是 。 (3)装置中浸碱面团的作用是 。 (4)如图将铜丝改为可抽动的铜丝符合化学实验“绿色化”的原因是______________________ (5)充分反应后,小组同学发现铜和硫酸都有剩余。若想使剩余的铜片继续溶解,可再加入 (填选项的字母)。A.HNO3 B.NaNO3 C.NaHCO3 D.Na2CO3 29(10分)下图中的每一个方格表示有关的一种反应物或生成物,其中为正盐,、、均为无色气体,且气体的水溶液显碱性。 (1)用化学用语按要求填空: X的化学式为:__________,X中含有化学键类型为__________;的电子式__________。 (2)写出反应②的离子方程式___________________________。 (3)过量的粉与的稀溶液反应,向反应后溶液中加入碱溶液,现象是____________________ 高二化学月考答案 1-5BADBD 6-10BCDCD 11-15BDDCC 16-20CCDBA 21-25CDDBC 26(12分)(1)MnO4- Cu2+ Ag+、Ba2+、Al3+ (2)Na+、CO32- (3)BaCO3;BaSO4 . 在沉淀乙中加足量的稀盐酸,若沉淀全部溶解则说明只有BaCO3,若不能全部溶解,说 明是BaCO3和BaSO4的混合物. BaCO3+2H+= Ba2+ + H2O+CO2↑ 27(12分)(1)过滤 (2)B、Al2O3 D、Fe2O3 E、(NH4)2SO4和NH3·H2O (3)①Al2O3 + 2 OH- = 2 AlO2- + H2O ③AlO2- + H+ + H2O = Al(OH)3↓ 28.(16分) (1) Cu +2H2SO4(浓) CuSO4 + SO2↑+2H2O (2分) (2) 放出的气体能使品红溶液褪色,(2分)证明二氧化硫有漂白性。(2分) 放出的气体使紫色石蕊溶液变红,(2分)证明二氧化硫有酸性。(2分) (3)吸收逸出的SO2气体,防止污染空气。 (2分) (4)通过调节铜丝的高度,可以控制参加反应的铜与浓硫酸的接触面积(1分),从而控制SO2产生的量,减少SO2的污染。(1分) (5)AB (2分) 29.(10分) 【来源:全,品…中&高*考+网】查看更多