- 2021-07-02 发布 |
- 37.5 KB |
- 33页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2018届江苏省宿迁市高二上学期期末化学试卷(选修) (解析版)
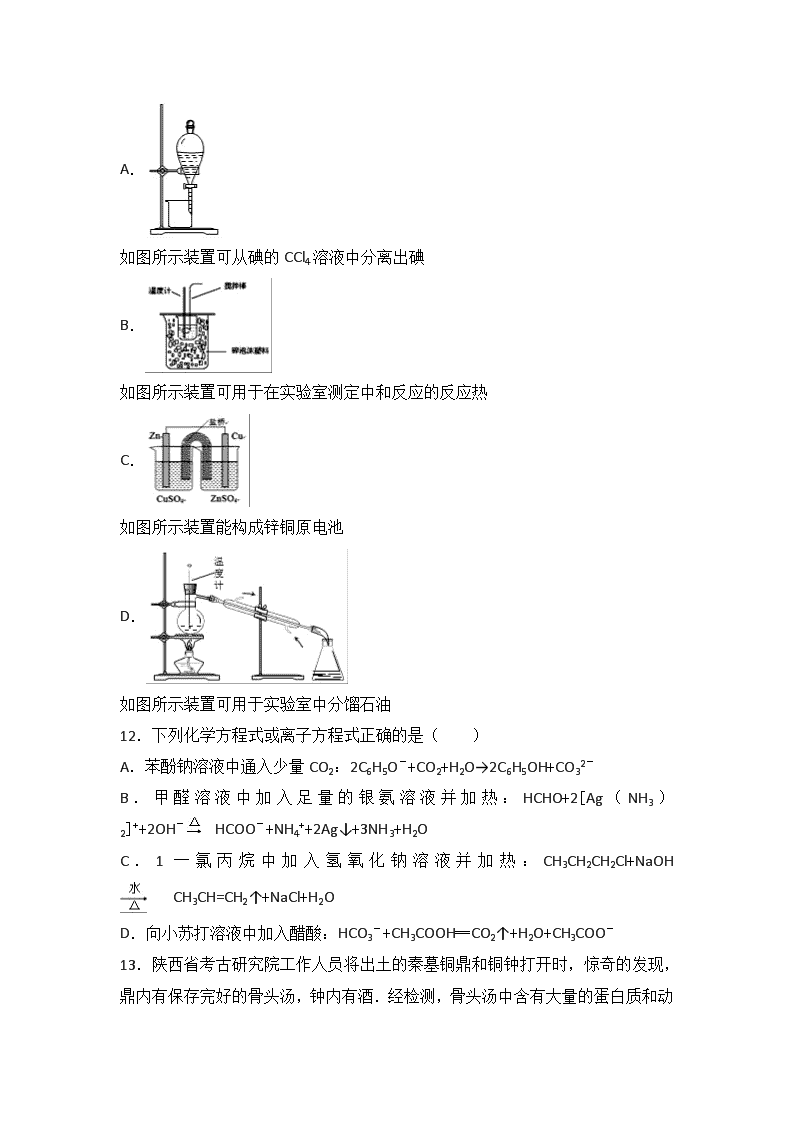
2016-2017学年江苏省宿迁市高二(上)期末化学试卷(选修) 一、单项选择题(本题包括10小题,每题2分,共20分。每小题只有一个选项符合题意) 1.在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%.①化合反应 ②分解反应 ③酯化反应 ④取代反应 ⑤加成反应 ⑥消去反应 ⑦加聚反应 ⑧缩聚反应,上述反应类型中,能体现这一原子最经济原则的是( ) A.①②⑤ B.①⑤⑦ C.②⑦⑧ D.④⑥⑧ 2.下列有关化学用语表示正确的是( ) A.乙烯的结构简式:CH2CH2 B.醛基的电子式: C.乙酸的最简式:CH2O D.乙醇分子比例模型: 3.下列说法不正确的是( ) A.用元素分析仪来确定有机化合物的组成具有快速、微量、精确等特点 B.根据1H核磁共振谱图可以推知有机物分子中有几种不同类型的氢原子 C.用铜丝燃烧法可定性确定有机物中是否存在卤素 D.通过红外光谱可以测知有机物的相对分子质量 4.下列有机物分子中所有的原子不可能处于同一平面的是( ) A.1,3﹣丁二烯 B.乙烷 C.苯乙烯 D.甲醛 5.下列分子式只表示一种物质的是( ) A.C2H6 B.C2H4O2 C.C2H6O D.C2H4Cl2 6.下列关于官能团的判断中说法不正确的是( ) A.醇的官能团是羟基(﹣OH) B.酚的官能团是羟基(﹣OH) C.醛的官能团是醛基(﹣CHO) D.羧酸的官能团是羟基(﹣OH) 7.下述实验能达到预期目的是( ) 编号 实验操作 实验目的 A 除去甲烷中混有的乙烯 将甲烷和乙烯的混合气体通过盛有溴水的洗气瓶 B 在苯和苯酚的混合液中加入足量的浓溴水,振荡、过滤 分离出苯酚 C 向CH2=CHCHO溶液中滴入KMnO4酸性溶液 证明CH2=CHCHO中含有碳碳双键 D 先加NaOH溶液共热,然后加入AgNO3溶液 检验溴乙烷中含有溴元素 A.A B.B C.C D.D 8.下列有机物命名正确的是( ) A.3,3﹣二甲基丁烷 B.3,3,4﹣三甲基戊烷 C.2,3﹣二甲基﹣4﹣戊烯 D.3﹣甲基﹣1﹣戊烯 9.含20.0g NaOH的稀溶液与稀硝酸完全反应时,放出28.7kJ的热量,表示该反应的热化学方程式正确的是( ) A.NaOH(aq)+HNO3(aq)=NaNO3 (aq)+H2O(l)△H=+28.7kJ•mol﹣1 B.NaOH+HNO3=NaNO3+H2O△H=﹣28.7kJ•mol﹣1 C.NaOH(aq)+HNO3 (aq)=NaNO3 (aq)+H2O(l)△H=﹣57.4 kJ•mol﹣1 D.NaOH(aq)+HNO3 (aq)=NaNO3 (aq)+H2O(l)△H=﹣57.4 kJ 10.下列描述中正确的是( ) A.需要加热才能发生的反应一定是吸热反应 B.在25℃、101 kPa时,1 mol碳燃烧所放出的热量为碳的标准燃烧热 C.从C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•mol﹣1,可知石墨比金刚石更稳定 D.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 二、不定项选择题(本题包括5小题,每小题4分,共20分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分。) 11.下列实验装置图正确且能达到实验目的是( ) A. 如图所示装置可从碘的CCl4溶液中分离出碘 B. 如图所示装置可用于在实验室测定中和反应的反应热 C. 如图所示装置能构成锌铜原电池 D. 如图所示装置可用于实验室中分馏石油 12.下列化学方程式或离子方程式正确的是( ) A.苯酚钠溶液中通入少量CO2:2C6H5O﹣+CO2+H2O→2C6H5OH+CO32﹣ B.甲醛溶液中加入足量的银氨溶液并加热:HCHO+2[Ag(NH3)2]++2OH﹣HCOO﹣+NH4++2Ag↓+3NH3+H2O C.1一氯丙烷中加入氢氧化钠溶液并加热:CH3CH2CH2Cl+NaOH CH3CH=CH2↑+NaCl+H2O D.向小苏打溶液中加入醋酸:HCO3﹣+CH3COOH═CO2↑+H2O+CH3COO﹣ 13.陕西省考古研究院工作人员将出土的秦墓铜鼎和铜钟打开时,惊奇的发现,鼎内有保存完好的骨头汤,钟内有酒.经检测,骨头汤中含有大量的蛋白质和动物脂肪,酒中含有乙醇、乙酸和乙酸乙酯.下列说法中正确的是( ) A.淀粉、油脂、蛋白质都是高分子化合物 B.淀粉、油脂、蛋白质的水解产物互为同分异构体 C.油脂通过皂化反应生成肥皂的有效成分高级脂肪酸钠 D.酒中含有乙酸,是因为乙醇长期放置在空气中,在微生物作用下“酒败成醋” 14.有机物分子中,当某个碳原子连接着四个不同的原子或原子团时,这种碳原子称为“手性碳原子”.例如,如图有机物分子中带“*”碳原子就是手性碳原子.该有机物分别发生下列应,生成的有机物分子中仍含有手性碳原子的是( ) A.发生银镜反应 B.与NaOH水溶液反应 C.催化剂作用下与H2反应 D.与乙酸发生酯化反应 15.中药狼巴草的成分之一M具有清炎杀菌作用,M的结构简式如图所示:,下列叙述正确的是( ) A.M的分子式为C9H6O4 B.1 mol M最多能与2 mol Br2发生反应 C.1 molM最多能与4 mol氢氧化钠反应 D.M既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 三、解答题(共6小题,满分80分) 16.按要求完成下列填空 (1)写出CH3CH=CH2的键线式 (2)乙炔的空间构型是 (3)主链有4个碳原子且分子式为C4H10的物质的结构简式是 (4)用系统命名法命名下列有机物: ①CH3CH(CH3)CH(CH3)CH2CH3 ②CH3CH(CH3)CH2OH (5)高聚物的单体是 . 17.下面有6种有机物,用提供的试剂分别鉴别,将所用试剂及产生现象的序号填在各个横线上. 有机物 试剂 现象 (1)甲苯 a.碘水 A.出现光亮的银镜 (2)乙醛 b.高锰酸钾酸性溶液 B.呈紫色 (3)苯酚 c.浓硝酸 C.呈蓝色 (4)淀粉 d.新制银氨溶液 D.呈黄色 (5)蛋白质 e.三氯化铁溶液 E.紫色褪去 (1) ;(2) ;(3) ;(4) ;(5) . 18.有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源. (1)氢能被称为绿色能源的原因是 (任答一点) (2)在101KP下,2g氢气完全燃烧生成液态水放出285.8kJ的热量,请回答下列问题 ①该反应生成物总能量 反应物总能量(填“大于”,“小于”或“等于”) ②氢气的燃烧热为 ③该反应的热化学方程式为 ④若1mol氢气完全燃烧生成1mol气态水放出241kJ的热量,已知H﹣H键能为436kJ•mol﹣1,O=O键能为498kJ•mol﹣1,计算H﹣O键能为 kJ•mol﹣1 (3)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知: Mg(s)+H2(g)═MgH2(s)△H1=﹣74.5kJ•mol﹣1; Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=﹣64.4kJ•mol﹣1; Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3. 则△H3= kJ•mol﹣1. 19.铁、铝及其化合物在生产和生活中有着广泛的应用. (1)工业上冶炼铝的化学方程式是 . (2)我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流.电池总反应为4Al+3O2+6H2O═4Al(OH)3,则负极反应式为 . (3)某研究性学习小组设计了如图1所示装置探究钢铁的腐蚀与防护.在相同条件下,三组装置中铁电极腐蚀最快的是 (填序号),为防止金属Fe被腐蚀,可以采用上述 (填序号)装置原理进行防护. (4)如图2所示,若电解5min时C池中铁棒质量增加2.16g,据此回答:则该电源电极Y名称为 ,流过导线的电子物质的量是 ,A池中碳棒上的电极反应式是 ,B池中粗铜电极上存在的电极反应式是 ,C池中一段时间后硝酸银溶液浓度 (填增大,减小或不变). 20.丙烯是一种重要的化工原料.2000年以来,我国丙烯的使用量已超过乙烯,且已知保持增长趋势.现以丙烯为原料合成环酯G和高聚物(C3H4O2)n 已知:F的分子式为C3H4O2;有机物G的分子式为C6H8O4,含有一个六元环. (1)E中含氧官能团的名称是 . (2)B→C的反应类型是 ;E→F的反应类型是 . (3)有机物C的结构简式为 . (4)由F合成高聚物(C3H4O2)n的化学方程式为 ;由E合成G的化学方程式为 . 21.某芳香烃X(相对分子质量为92)是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去).其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO. 已知: (1)F的结构简式是 ,反应①~⑤中属于取代反应的有 . (2)反应②③两步能否互换 (填“能”或“不能”),理由是 . (3)B→C的化学方程式是 . (4)有多种同分异构体,请写出符合下列条件的同分异构体的结构简式 (任写一种) ①能发生银镜反应 ②含有苯环且分子中有四种不同化学环境的氢原子 ③1mol该有机物最多能与2molNaOH反应. (5)请用合成反应流程图表示出由和其他无机试剂合成最合理的方案. 示例:H2C=CH2CH3CH2BrCH3CH2OH. 2016-2017学年江苏省宿迁市高二(上)期末化学试卷(选修) 参考答案与试题解析 一、单项选择题(本题包括10小题,每题2分,共20分。每小题只有一个选项符合题意) 1.在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%.①化合反应 ②分解反应 ③酯化反应 ④取代反应 ⑤加成反应 ⑥消去反应 ⑦加聚反应 ⑧缩聚反应,上述反应类型中,能体现这一原子最经济原则的是( ) A.①②⑤ B.①⑤⑦ C.②⑦⑧ D.④⑥⑧ 【考点】绿色化学. 【分析】根据题中信息“绿色化学”工艺的要求:反应物全部转化为期望的产物,使原子的利用率达到100%,可知反应只生成一种生成物,据此即可解答. 【解答】解:“绿色化学”工艺的要求:反应物全部转化为期望的产物,使原子的利用率达到100%,可知反应只生成一种生成物,该反应为①化合反应、⑤加成反应、⑦加聚反应,而其他类型的反应反应生成物不止一种,不能体现原子利用率为100%.故选B. 2.下列有关化学用语表示正确的是( ) A.乙烯的结构简式:CH2CH2 B.醛基的电子式: C.乙酸的最简式:CH2O D.乙醇分子比例模型: 【考点】电子式. 【分析】A.乙烯分子式为C2H4,两个碳原子之间通过共用2对电子形成一个碳碳双键,结构简式碳碳双键不能省略; B.醛基中碳原子含有一个孤电子,碳原子和氢原子形成一对共用电子对,和氧原子应形成两对共用电子对; C.最简式又称实验式或经验式,是化学式中的一种,是用元素符号表示化合物分子中各元素的原子个数比的最简关系式; D.比例模型主要体现的是组成该分子的原子间的大小关系与原子间连接,球棍模型主要体现的是分子的空间结构和成键类型,图示为球棍模型. 【解答】解:A.乙烯分子中含有2个碳原子和4个氢原子,两个碳原子之间通过共用2对电子形成一个碳碳双键,电子式为:,结构式为:,结构简式为:CH2=CH2,故A错误; B.醛基中碳原子含有一个孤电子,碳原子和氧原子形成两对共用电子对、和氢原子形成一对共用电子对,所以其电子式为,故B错误; C.乙酸的分子式为C2H4O2,乙酸的最简式为CH2O,故C正确; D.图为乙醇分子的球棍模型,乙醇分子的比例模型图:,故D错误; 故选C. 3.下列说法不正确的是( ) A.用元素分析仪来确定有机化合物的组成具有快速、微量、精确等特点 B.根据1H核磁共振谱图可以推知有机物分子中有几种不同类型的氢原子 C.用铜丝燃烧法可定性确定有机物中是否存在卤素 D.通过红外光谱可以测知有机物的相对分子质量 【考点】有关有机物分子式确定的计算. 【分析】A.元素分析仪特点是样品量小,速度快; B.核磁共振氢谱中吸收峰的数目等于于有机物分子中H原子种类,H原子数目之比等于对应峰的面积之比; C.卤化铜灼烧时为绿色; D.红外光谱可测定有机物的共价键以及官能团. 【解答】解:A.元素分析仪可同时对有机物中碳、氢、氧、硫等多种元素进行分析,其特点是样品量小,速度快,故A正确; B.核磁共振氢谱中吸收峰的数目等于有机物分子中H原子种类,H原子数目之比等于对应峰的面积之比,可以推知有机物分子中有几种不同类型的氢原子及它们的数目,故B正确; C.卤化铜灼烧时为绿色,则铜丝灼烧法可定性确定有机物中是否存在卤素,故C正确; D.红外光谱可测定有机物的共价键以及官能团,不能确定有机物的相对分子质量,故D错误. 故选D. 4.下列有机物分子中所有的原子不可能处于同一平面的是( ) A.1,3﹣丁二烯 B.乙烷 C.苯乙烯 D.甲醛 【考点】常见有机化合物的结构. 【分析】在常见的有机化合物中甲烷是正四面体结构,甲醛、乙烯和苯是平面型结构,乙炔是直线型结构,其它有机物可在此基础上进行判断. 【解答】解:A.乙烯具有平面型结构,CH2=CH﹣CH=CH2,可看作乙烯基取代乙烯中的一个氢原子,所有原子一定处于同一平面,故A不符合; B.乙烷是饱和烷烃,碳原子周围形成的是四面体结构,不能共平面,故B符合; C.乙烯和苯是平面型结构,苯乙烯可看作是苯基取代乙烯中的一个氢原子,所以所有原子可能处于同一平面,故C不符合; D.甲醛是平面型分子,因此所有原子都处于同一平面上,故D不符合; 故选B. 5.下列分子式只表示一种物质的是( ) A.C2H6 B.C2H4O2 C.C2H6O D.C2H4Cl2 【考点】混合物和纯净物. 【分析】分子式只能表示一种物质,就是说它不存在同分异构体.同分异构体是分子式相同,但结构不同的化合物,根据是否存在同分异构体判断正误. 【解答】解:A、C2H6为烷烃,不存在同分异构体,表示一种物质,故A正确; B、C2H4O2 可以是乙酸、甲酸甲酯等物质,存在同分异构体,所以不能表示一种物质,故B错误; C、C2H6O可以存在同分异构体,可以是CH3CH2OH,CH3OCH3,所以不能只表示一种物质,故C错误; D、C2H4Cl2有1,1﹣二氯乙烷和1,2﹣二氯乙烷两种同分异构体,故D错误. 故选A. 6.下列关于官能团的判断中说法不正确的是( ) A.醇的官能团是羟基(﹣OH) B.酚的官能团是羟基(﹣OH) C.醛的官能团是醛基(﹣CHO) D.羧酸的官能团是羟基(﹣OH) 【考点】烃的衍生物官能团. 【分析】官能团决定有机化合物的性质,常见的官能团有:﹣OH、C=C、﹣CHO、﹣COOH等,注意羧酸的官能团为羧基﹣COOH,以此来解答. 【解答】解:A.醇的官能团为羟基,如乙醇中含﹣OH,与烃基相连,故A正确; B.酚的官能团是羟基,如苯酚中含酚﹣OH,与苯环直接相连,故B正确; C.醛的官能团是醛基,结构简式为﹣CHO,故C正确; D.羧酸的官能团为羧基:﹣COOH,不是羟基,故D错误; 故选D. 7.下述实验能达到预期目的是( ) 编号 实验操作 实验目的 A 将甲烷和乙烯的混合气体通过盛有溴水的洗气瓶 除去甲烷中混有的乙烯 B 在苯和苯酚的混合液中加入足量的浓溴水,振荡、过滤 分离出苯酚 C 向CH2=CHCHO溶液中滴入KMnO4酸性溶液 证明CH2=CHCHO中含有碳碳双键 D 先加NaOH溶液共热,然后加入AgNO3溶液 检验溴乙烷中含有溴元素 A.A B.B C.C D.D 【考点】化学实验方案的评价. 【分析】A.甲烷不与溴反应,而乙烯与溴发生加成反应; B.苯酚能够溶于有机溶剂苯,无法通过过滤分离; C.碳碳双键和醛基都能够时酸性高锰酸钾溶液褪色; D.加入硝酸银溶液前必须用稀硝酸中和过量的氢氧化钠. 【解答】解:A.由于甲烷不与溴水反应、而乙烯与溴反应,可将甲烷和乙烯的混合气体通过盛有溴水的洗气瓶,除去甲烷中混有的乙烯,故A正确; B.由于苯酚溶于苯,不会析出沉淀,应该用氢氧化钠溶液分离,故B错误; C.向CH2=CHCHO溶液中滴入KMnO4酸性溶液,由于碳碳双键和醛基都能够被酸性高锰酸钾溶液氧化,无法据此证明CH2=CHCHO中含有碳碳双键,故C错误; D.先加NaOH溶液共热,冷却后用浓硝酸中和氢氧化钠,然后再加入AgNO3溶液检验溴乙烷中含有溴元素,否则氢氧根离子干扰了溴离子的检验,故D错误; 故选A. 8.下列有机物命名正确的是( ) A.3,3﹣二甲基丁烷 B.3,3,4﹣三甲基戊烷 C.2,3﹣二甲基﹣4﹣戊烯 D.3﹣甲基﹣1﹣戊烯 【考点】有机化合物命名. 【分析】判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范: (1)烷烃命名原则: ①长:选最长碳链为主链; ②多:遇等长碳链时,支链最多为主链; ③近:离支链最近一端编号; ④小:支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近﹣﹣﹣﹣﹣离支链最近一端编号”的原则; ⑤简:两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面; (2)有机物的名称书写要规范; (3)对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名; (4)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小. 【解答】解:A、烷烃命名时,要从离支链近的一端给主链上的碳原子编号,故此烷烃的正确命名为2,2﹣二甲基丁烷,故A错误; B、烷烃命名时,要选最长的碳链为主链,然后从离支链近的一端给主链上的碳原子编号,故名称为:2,3,3﹣三甲基戊烷,故B错误; C、烯烃命名时,要选含官能团的最长的碳链为主链,从离官能团近的一端给主链上的碳原子编号,故在3号和4号碳原子上各有一个甲基,在1号和2号碳原子间有碳碳双键,故名称为3,4﹣二甲基﹣1﹣戊烯,故C错误; D、烯烃命名时,要选含官能团的最长的碳链为主链,从离官能团近的一端给主链上的碳原子编号,故3号碳原子上各有一个甲基,在1号和2号碳原子间有碳碳双键,故名称为3﹣甲基﹣1﹣戊烯,故D正确. 故选D. 9.含20.0g NaOH的稀溶液与稀硝酸完全反应时,放出28.7kJ的热量,表示该反应的热化学方程式正确的是( ) A.NaOH(aq)+HNO3(aq)=NaNO3 (aq)+H2O(l)△H=+28.7kJ•mol﹣1 B.NaOH+HNO3=NaNO3+H2O△H=﹣28.7kJ•mol﹣1 C.NaOH(aq)+HNO3 (aq)=NaNO3 (aq)+H2O(l)△H=﹣57.4 kJ•mol﹣1 D.NaOH(aq)+HNO3 (aq)=NaNO3 (aq)+H2O(l)△H=﹣57.4 kJ 【考点】热化学方程式. 【分析】n(NaOH)==0.5mol,与稀硝酸完全反应时,放出28.7kJ的热量,则1molNaOH与稀硝酸完全反应时,放出热量为28.7kJ×2=57.4 kJ,中和反应为放热反应,焓变为负,结合物质的状态来解答. 【解答】解:n(NaOH)==0.5mol,与稀硝酸完全反应时,放出28.7kJ的热量,则1molNaOH与稀硝酸完全反应时,放出热量为28.7kJ×2=57.4 kJ,中和反应为放热反应,焓变为负,在溶液中的离子反应,只有水为液体,则该反应的热化学方程式为NaOH(aq)+HNO3 (aq)=NaNO3 (aq)+H2O(l)△H=﹣57.4 kJ•mol﹣1, 故选C. 10.下列描述中正确的是( ) A.需要加热才能发生的反应一定是吸热反应 B.在25℃、101 kPa时,1 mol碳燃烧所放出的热量为碳的标准燃烧热 C.从C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•mol﹣1,可知石墨比金刚石更稳定 D.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 【考点】反应热和焓变. 【分析】A.反应是否加热才能进行与反应热无关; B.碳可生成一氧化碳或二氧化碳; C.为吸热反应,反应物总能量较低; D.反应热的大小与反应条件无关. 【解答】解:A.反应是否加热才能进行与反应热无关,如铝热反应为放热反应,但需在高温下才能进行,故A错误; B.碳可生成一氧化碳或二氧化碳,如生成一氧化碳,则不是燃烧热,故B错误; C.C(石墨,s)=C(金刚石,s)△H=+1.9 kJ•mol﹣1为吸热反应,反应物总能量较低,能量较低的温度,故C正确; D.反应热的大小与反应条件无关,故D错误. 故选C. 二、不定项选择题(本题包括5小题,每小题4分,共20分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的得2分,选两个且都正确的得满分,但只要选错一个,该小题就为0分。) 11.下列实验装置图正确且能达到实验目的是( ) A. 如图所示装置可从碘的CCl4溶液中分离出碘 B. 如图所示装置可用于在实验室测定中和反应的反应热 C. 如图所示装置能构成锌铜原电池 D. 如图所示装置可用于实验室中分馏石油 【考点】化学实验方案的评价;实验装置综合. 【分析】A.碘的CCl4溶液互溶,但沸点不同; B.温度计测定温度,泡沫和硬纸板可隔热,搅拌器搅拌液体; C.左侧烧杯发生化学反应,不能构成原电池; D.蒸馏时温度计测定馏分的温度. 【解答】解:A.碘的CCl4溶液互溶,但沸点不同,不能分液分离,应选蒸馏法,故A错误; B.温度计测定温度,泡沫和硬纸板可隔热,搅拌器搅拌液体,则图中装置可测定中和热,故B正确; C.左侧烧杯发生化学反应,不能构成原电池,应将电解质互换,故C错误; D.蒸馏时温度计测定馏分的温度,温度计的水银球应在烧瓶的支管口处,故D错误; 故选B. 12.下列化学方程式或离子方程式正确的是( ) A.苯酚钠溶液中通入少量CO2:2C6H5O﹣+CO2+H2O→2C6H5OH+CO32﹣ B.甲醛溶液中加入足量的银氨溶液并加热:HCHO+2[Ag(NH3)2]++2OH﹣HCOO﹣+NH4++2Ag↓+3NH3+H2O C.1一氯丙烷中加入氢氧化钠溶液并加热:CH3CH2CH2Cl+NaOH CH3CH=CH2↑+NaCl+H2O D.向小苏打溶液中加入醋酸:HCO3﹣+CH3COOH═CO2↑+H2O+CH3COO﹣ 【考点】离子方程式的书写. 【分析】A.苯酚的酸性大于碳酸氢根离子,二者反应生成的碳酸氢钠; B.甲醛中含2个﹣CHO,生成4molAg; C.在氢氧化钠的水溶液中,卤代烃发生水解反应,不发生消去反应; D.小苏打为碳酸氢钠,碳酸钠与醋酸反应生成醋酸钠、二氧化碳气体和水. 【解答】解:A.苯酚钠溶液中通入少量CO2,二者反应生成苯酚和碳酸氢钠,正确的离子方程式为:C6H5O﹣+CO2+H2O→C6H5OH+HCO3﹣,故A错误; B.甲醛溶液中加入足量的银氨溶液并加热的离子反应为HCHO+4[Ag(NH3)2]++4OH﹣CO32﹣+2NH4++4Ag↓+6NH3+2H2O,故B错误; C.1一氯丙烷中加入氢氧化钠溶液并加热,二者发生水解反应,正确的离子方程式为:CH3CH2CH2Cl+NaOH CH3CH2CH2OH+NaCl,故C错误; D.向小苏打溶液中加入醋酸,反应的离子反应为:HCO3﹣+CH3COOH═CO2↑+H2O+CH3COO﹣,故D正确; 故选D. 13.陕西省考古研究院工作人员将出土的秦墓铜鼎和铜钟打开时,惊奇的发现,鼎内有保存完好的骨头汤,钟内有酒.经检测,骨头汤中含有大量的蛋白质和动物脂肪,酒中含有乙醇、乙酸和乙酸乙酯.下列说法中正确的是( ) A.淀粉、油脂、蛋白质都是高分子化合物 B.淀粉、油脂、蛋白质的水解产物互为同分异构体 C.油脂通过皂化反应生成肥皂的有效成分高级脂肪酸钠 D.酒中含有乙酸,是因为乙醇长期放置在空气中,在微生物作用下“酒败成醋” 【考点】有机物的结构和性质. 【分析】A.高分子化合物的相对分子质量在10000以上; B.淀粉、油脂、蛋白质的水解产物组成不同,分子式不同; C.油脂通过皂化反应生成高级脂肪酸钠和甘油; D.乙醇可被氧化生成乙酸. 【解答】解:A.油脂的相对分子质量较小,不是高分子化合物,故A错误; B.淀粉、油脂、蛋白质的水解产物分别为葡萄糖、高级脂肪酸、氨基酸等,组成不同,分子式不同,不是同分异构体,故B错误; C.油脂通过皂化反应生成高级脂肪酸钠和甘油,高级脂肪酸钠可用于制肥皂,故C正确; D.乙醇可被氧化生成乙酸,乙醇中含有乙酸、乙酸乙酯等,故D正确. 故选CD. 14.有机物分子中,当某个碳原子连接着四个不同的原子或原子团时,这种碳原子称为“手性碳原子”.例如,如图有机物分子中带“*”碳原子就是手性碳原子.该有机物分别发生下列应,生成的有机物分子中仍含有手性碳原子的是( ) A.发生银镜反应 B.与NaOH水溶液反应 C.催化剂作用下与H2反应 D.与乙酸发生酯化反应 【考点】有机物的结构和性质. 【分析】 根据题意知,手性碳原子连接4个不同的原子或原子团,如果反应后的生成物的碳原子上连接4个不同的原子或原子团,则其生成物就含有手性碳原子,据此分析解答. 【解答】解:A.该有机物与银氨溶液反应后的生成的有机物中,原来的手性碳原子现在连接的原子或原子团是:一个溴原子、一个﹣CH2OH、一个CH3COOCH2﹣、一个﹣COOH,所以该原子仍然是手性碳原子,故A正确; B.该有机物与氢氧化钠溶液反应后生成的醇中,原来的手性碳原子现在连接两个﹣CH2OH,所以没有手性碳原子,故B错误; C.该有机物在催化剂作用下与氢气反应,原来的手性碳原子现在连接两个﹣CH2OH,所以没有手性碳原子,故C错误; D.该有机物与乙酸反应生成的酯中,原来的手性碳原子现在连接两个CH3COOCH2﹣,所以没有手性碳原子,故D错误; 故选A. 15.中药狼巴草的成分之一M具有清炎杀菌作用,M的结构简式如图所示:,下列叙述正确的是( ) A.M的分子式为C9H6O4 B.1 mol M最多能与2 mol Br2发生反应 C.1 molM最多能与4 mol氢氧化钠反应 D.M既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体 【考点】有机物的结构和性质. 【分析】由结构可知分子式,分子中含酚﹣OH、碳碳双键、﹣COOC﹣,结合酚、烯烃、酯的性质来解答. 【解答】解:A.由结构可知分子式为C9H6O4,故A正确; B.酚﹣OH的邻位与溴发生取代,碳碳双键与溴发生加成,则1 mol M最多能与3 mol Br2发生反应,故B错误; C.酚﹣OH、﹣COOC﹣及水解生成的酚﹣OH均与NaOH反应,则1 molM最多能与4 mol氢氧化钠反应,故C正确; D.含酚﹣OH与FeCl3溶液发生显色反应,但与NaHCO3溶液不反应,故D错误; 故选AC. 三、解答题(共6小题,满分80分) 16.按要求完成下列填空 (1)写出CH3CH=CH2的键线式 (2)乙炔的空间构型是 直线型 (3)主链有4个碳原子且分子式为C4H10的物质的结构简式是 CH3CH2CH2CH3 (4)用系统命名法命名下列有机物: ①CH3CH(CH3)CH(CH3)CH2CH3 2,3﹣二甲基戊烷 ②CH3CH(CH3)CH2OH 2﹣甲基﹣1﹣丙醇 (5)高聚物的单体是 CH2=CHCl . 【考点】有机化合物命名. 【分析】(1)键线式中用短线“﹣”表示化学键,端点、交点表示碳原子,C原子、H原子不需要标出,利用H原子饱和C的四价结构,杂原子及杂原子上的H原子需要标出; (2)乙炔是直线型分子,碳原子是sp杂化; (3)主链有4个碳原子且分子式为C4H10的物质为烷烃,主碳链4个碳原子; (4)判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范: A.烷烃命名原则: ①长﹣﹣﹣﹣﹣选最长碳链为主链; ②多﹣﹣﹣﹣﹣遇等长碳链时,支链最多为主链; ③近﹣﹣﹣﹣﹣离支链最近一端编号; ④小﹣﹣﹣﹣﹣支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近﹣﹣﹣﹣﹣离支链最近一端编号”的原则; ⑤简﹣﹣﹣﹣﹣两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面. B.有机物的名称书写要规范; C.对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名; D.含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小; (5)高聚物单体的判断方法:凡链节的主链上只有两个碳原子(无其它原子)的高聚物,其合成单体必为一种,将两半链闭合即可;凡链节主链上只有四个碳原子(无其它原子)且链节无双键的高聚物,其单体必为两种,在正中间画线断开,然后将四个半键闭合;凡链节主链上只有碳原子并存在碳碳双键结构的高聚物,其规律是“见双键,四个碳,无双键,两个碳”画线断开,然后将半键闭合,即将单双键互换. 【解答】解:(1)CH3CH=CH2的键线式为:,故答案为:; (2)乙炔中碳原子是sp杂化,是直线型分子,故答案为:直线型; (3)主链有4个碳原子且分子式为C4H10的物质为烷烃,主碳链4个碳原子,结构简式为:CH3 CH2CH2CH3, 故答案为:CH3 CH2CH2CH3; (4)①选取最长碳链为主碳链含5个碳原子,离取代基近的一端给主碳链编号,得到名称为:2,3﹣二甲基戊烷,共含7个碳原子的烷烃,分子式为:C7H16 , 故答案为:2,3﹣二甲基戊烷; ②CH3CH(CH3)CH2OH,选取含羟基碳在内的最长碳链为主碳链有3个碳原子,离羟基近的一端给主碳链编号确定取代基位置,得到名称为:2﹣甲基﹣1﹣丙醇, 故答案为:2﹣甲基﹣1﹣丙醇; (5)高聚物的单体是CH2=CHCl,故答案为:CH2=CHCl. 17.下面有6种有机物,用提供的试剂分别鉴别,将所用试剂及产生现象的序号填在各个横线上. 有机物 试剂 现象 (1)甲苯 a.碘水 A.出现光亮的银镜 (2)乙醛 b.高锰酸钾酸性溶液 B.呈紫色 (3)苯酚 c.浓硝酸 C.呈蓝色 (4)淀粉 d.新制银氨溶液 D.呈黄色 (5)蛋白质 e.三氯化铁溶液 E.紫色褪去 (1) bE ;(2) dA ;(3) eB ;(4) aC ;(5) cD . 【考点】有机物的鉴别. 【分析】(1)甲苯可被高锰酸钾氧化; (2)乙醛含有醛基,可发生银镜反应; (3)苯酚可与氯化铁发生显色反应; (4)淀粉遇碘变蓝色; (5)蛋白质可与浓硝酸发生显色反应. 【解答】解:(1)甲苯可被高锰酸钾氧化,可观察到紫色褪去; (2)乙醛含有醛基,可发生银镜反应,可出现光亮的银; (3)苯酚可与氯化铁发生显色反应,溶液呈紫色; (4)淀粉遇碘变蓝色; (5)蛋白质可与浓硝酸发生显色反应,蛋白质变为黄色. 故答案为:(1)bE;(2)dA;(3)eB;(4)aC;(5)cD. 18.有科学家预言,氢能将成为21世纪的主要能源,而且是一种理想的绿色能源. (1)氢能被称为绿色能源的原因是 无污染 (任答一点) (2)在101KP下,2g氢气完全燃烧生成液态水放出285.8kJ的热量,请回答下列问题 ①该反应生成物总能量 小于 反应物总能量(填“大于”,“小于”或“等于”) ②氢气的燃烧热为 285.8kJ•mol﹣1 ③该反应的热化学方程式为 2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJ•mol﹣1 ④若1mol氢气完全燃烧生成1mol气态水放出241kJ的热量,已知H﹣H键能为436kJ•mol﹣1,O=O键能为498kJ•mol﹣1,计算H﹣O键能为 463 kJ•mol﹣1 (3)氢能的存储是氢能利用的前提,科学家研究出一种储氢合金Mg2Ni,已知: Mg(s)+H2(g)═MgH2(s)△H1=﹣74.5kJ•mol﹣1; Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=﹣64.4kJ•mol﹣1; Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3. 则△H3= +84.6 kJ•mol﹣1. 【考点】反应热和焓变. 【分析】(1)氢气燃烧生成水,无污染; (2)2g氢气为1mol,完全燃烧生成液态水放出285.8kJ的热量,可知燃烧热为285.8 kJ•mol﹣1,为放热反应,化学反应放出的热量=新键生成释放的能量﹣旧键断裂吸收的能量; (3)依据热化学方程式和盖斯定律计算得到所需让化学方程式, ①Mg(s)+H2(g)═MgH2(s)△H1=﹣74.5kJ•mol﹣1 ②Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=﹣64.4kJ•mol﹣1 Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3 由盖斯定律②﹣2×①得到. 【解答】解:(1)氢气燃烧生成水,无污染,为清洁能源,故答案为:无污染; (2)①为放热反应,则生成物的总能量小于反应物总能量,故答案为:小于; ②2g氢气为1mol,完全燃烧生成液态水放出285.8kJ的热量,可知燃烧热为285.8 kJ•mol﹣1,故答案为:285.8 kJ•mol﹣1; ③燃烧热为285.8 kJ•mol﹣1,则热化学方程式为2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJ•mol﹣1,故答案为:2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJ•mol﹣1; ④若1mol氢气完全燃烧生成1mol气态水放出241kJ的热量,已知H﹣H键能为436kJ•mol﹣1,O=O键能为498kJ•mol﹣1,燃烧的热化学方程式:2H2(g)+O2(g)═2H2O(g)△H=﹣484kJ/mol, 设形成1mol H﹣O键完全断裂时吸收热量为X kJ,436KJ×2+496KJ﹣4X=﹣482kJ, 解得X=463KJ, 故答案为:463; (3)①Mg(s)+H2(g)═MgH2(s)△H1=﹣74.5kJ•mol﹣1 ②Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=﹣64.4kJ•mol﹣1 Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3 由盖斯定律②﹣2×①得到Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3 =﹣64.4KJ/mol﹣2×(﹣74.5KJ/mol)=+84.6KJ/mol,则△H3=+84.6KJ/mol, 故答案为:+84.6. 19.铁、铝及其化合物在生产和生活中有着广泛的应用. (1)工业上冶炼铝的化学方程式是 2Al2O3 4Al+3O2↑ . (2)我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流.电池总反应为4Al+3O2+6H2O═4Al(OH)3,则负极反应式为 Al﹣3e﹣=Al3+ . (3)某研究性学习小组设计了如图1所示装置探究钢铁的腐蚀与防护.在相同条件下,三组装置中铁电极腐蚀最快的是 ① (填序号),为防止金属Fe被腐蚀,可以采用上述 ②③ (填序号)装置原理进行防护. (4)如图2所示,若电解5min时C池中铁棒质量增加2.16g,据此回答:则该电源电极Y名称为 负极 ,流过导线的电子物质的量是 0.02mol ,A池中碳棒上的电极反应式是 2Cl﹣﹣2e﹣=Cl2↑ ,B池中粗铜电极上存在的电极反应式是 Cu﹣2e﹣=Cu2+ ,C池中一段时间后硝酸银溶液浓度 不变 (填增大,减小或不变). 【考点】常见金属元素的单质及其化合物的综合应用;原电池和电解池的工作原理. 【分析】(1)工业上冶炼铝是电解熔融的氧化铝得到; (2)电池总反应为4Al+3O2+6H2O═4Al(OH)3,原电池中铝失电子做负极被氧化; (3)①装置为原电池铁为负极被腐蚀;②装置为原电池锌做负极被腐蚀,铁做正极被保护,称为牺牲阳极的阴极保护法;③装置为电解池,铁做阴极被保护,根据电极的腐蚀速率关系来判断; (4)如图2所示,若电解5min时C池中铁棒质量增加2.16g,则铁棒为阴极,Ag电极为阳极,依次纯铜做阴极,粗铜做阳极,A中铁棒做阴极,碳棒做阳极,X为正极,Y为负极,据此书写电极反应,结合电解过程中电极上电子守恒计算. 【解答】解:(1)工业上冶炼铝的化学方程式是:2Al2O34Al+3O2↑, 故答案为:2Al2O34Al+3O2↑; (2)我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流.电池总反应为4Al+3O2+6H2O═4Al(OH)3,铝做负极失电子被氧化,则负极反应式为:Al﹣3e﹣=Al3+, 故答案为:Al﹣3e﹣=Al3+; (3)①装置为原电池铁为负极被腐蚀;②装置为原电池锌做负极被腐蚀,铁做正极被保护;③装置为电解池,铁做阴极被保护;①组装置中铁电极腐蚀最快,正极反应是氧气得到电子发生还原反应,电极反应为:O2+2H2O+4e﹣=4OH﹣;②中负极上金属锌失电子,电极反应为:Zn﹣2e﹣=Zn2+,金属铁被保护,此时金属铁可以采牺牲阳极的阴极保护法,装置③中发生的是电解饱和食盐水的反应,阳极是氯离子失电子生成氯气,阴极是氢离子得到电子发生还原反应,阴极铁被保护, 故答案为:①;②③; (4)如图2所示,若电解5min时C池中铁棒质量增加2.16g,则C中铁棒为阴极,电极反应为:Ag++e﹣=Ag,增大的质量为析出银的质量,物质的量==0.02mol,电子转移总物质的量为0.02mol,Ag电极为阳极,电极反应为:Ag﹣e﹣=Ag+,C池为电镀池电解质溶液中溶质浓度不变, 分析判断,B装置中依次纯铜做阴极,电极反应为Cu2++2e﹣ =Cu,粗铜做阳极,电极反应为Cu﹣2e﹣=Cu2+,A装置中铁棒做阴极,电极反应为:2H++2e﹣=H2↑,碳棒做阳极,电极反应为:2Cl﹣﹣2e﹣=Cl2↑,X为正极,Y为负极, 故答案为:负极; 0.02mol; 2Cl﹣﹣2e﹣=Cl2↑;Cu﹣2e﹣=Cu2+;不变. 20.丙烯是一种重要的化工原料.2000年以来,我国丙烯的使用量已超过乙烯,且已知保持增长趋势.现以丙烯为原料合成环酯G和高聚物(C3H4O2)n 已知:F的分子式为C3H4O2;有机物G的分子式为C6H8O4,含有一个六元环. (1)E中含氧官能团的名称是 羟基、羧基 . (2)B→C的反应类型是 氧化反应 ;E→F的反应类型是 消去反应 . (3)有机物C的结构简式为 . (4)由F合成高聚物(C3H4O2)n的化学方程式为 ;由E合成G的化学方程式为 . 【考点】有机物的推断. 【分析】由F的分子式为C3H4O2,且可生成高聚物(C3H4O2)n,F中应含C=C,为CH2=CHCOOH,E可生成C6H8O4,含有一个六元环,则E为CH3CHOHCOOH,G为,由转化关系可知A为CH2ClCHClCH3,B为CH2OHCHOHCH3,C为,D为,以此解答该题. 【解答】解:(1)E为CH3CHOHCOOH,含有羟基、羧基,故答案为:羟基、羧基; (2)B为CH2OHCHOHCH3,C为,B→C的反应类型是氧化反应;E为CH3CHOHCOOH,F为CH2=CHCOOH,E→F的反应类型是消去反应, 故答案为:氧化反应;消去反应; (3)由以上分析可知C为,故答案为:; (4)由F合成高聚物(C3H4O2)n的化学方程式为,由E合成G的化学方程式为, 故答案为:; . 21.某芳香烃X(相对分子质量为92)是一种重要的有机化工原料,研究部门以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去).其中A是一氯代物,H是一种功能高分子,链节组成为C7H5NO. 已知: (1)F的结构简式是 ,反应①~⑤中属于取代反应的有 ① . (2)反应②③两步能否互换 不能 (填“能”或“不能”),理由是 防止氨基被氧化 . (3)B→C的化学方程式是 . (4)有多种同分异构体,请写出符合下列条件的同分异构体的结构简式 (或) (任写一种) ①能发生银镜反应 ②含有苯环且分子中有四种不同化学环境的氢原子 ③1mol该有机物最多能与2molNaOH反应. (5)请用合成反应流程图表示出由和其他无机试剂合成最合理的方案. 示例:H2C=CH2CH3CH2BrCH3CH2OH. 【考点】有机物的合成. 【分析】相对分子质量为92的某芳香烃X,令其分子组成为CxHy,分子中最大碳原子数为=7…8,由烷烃中C原子与H原子关系可知,该烃中C原子数目不能小于7,故该芳香烃X的分子式为C7H8,其结构简式为,X与氯气发生取代反应生成A为卤代烃,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,则A为、B为、C为,D酸化生成E,故D为,E为;由甲苯与反应③的产物结构,结合苯胺容易被氧化,应先用酸性高锰酸钾氧化甲基为﹣COOH,再还原硝基为氨基,故在浓硫酸、加热条件下与浓硝酸发生取代反应生成F为 ,F被酸性高锰酸钾氧化得到G为,G在Fe/HCl条件下硝基被还原生成,H是一种功能高分子,链节组成为C7H5NO,与的分子式相比减少1分子H2O,该反应为通过形成肽键发生缩聚反应生成高聚物,则H为; (5)中在催化剂条件下发生加成反应生成,再在氢氧化钠醇溶液、加热条件下发生消去反应生成,与氯气发生加成反应生成,最后在氢氧化钠水溶液中发生水解反应生成,据此进行解答. 【解答】解:相对分子质量为92的某芳香烃X,令其分子组成为CxHy,分子中最大碳原子数为=7…8,由烷烃中C原子与H原子关系可知,该烃中C原子数目不能小于7,故该芳香烃X的分子式为C7H8,其结构简式为;X与氯气发生取代反应生成A为卤代烃,A转化生成B,B催化氧化生成C,C能与银氨溶液反应生成D,故B含有醇羟基、C含有醛基,则A为,B为,C为,D酸化生成E,故D为,E为.由甲苯与反应③的产物结构,结合苯胺容易被氧化,应先用酸性高锰酸钾氧化甲基为﹣COOH,再还原硝基为氨基,故在浓硫酸、加热条件下与浓硝酸发生取代反应生成F为 ,F被酸性高锰酸钾氧化得到G为,G再Fe/HCl条件下硝基被还原生成,H是一种功能高分子,链节组成为C7H5NO,与的分子式相比减少1分子H2O,该反应为通过形成肽键发生缩聚反应生成高聚物,则H为, (1)根据分析可知,F的结构简式为:; 反应①是在浓硫酸、加热条件下与浓硝酸发生取代反应生成F; 反应②是在酸性高锰酸钾条件下反应氧化反应生成,该反应为氧化反应; 反应③为G在Fe/HCl条件下硝基被还原生成,该反应为还原反应; 反应④为通过形成肽键发生缩聚反应生成高聚物H,该反应为缩聚反应; 反应⑤是C与银氨溶液生成: ,该反应为氧化反应, 根据分析可知,属于取代反应的为①, 故答案为:;①; (2)反应②是在酸性高锰酸钾条件下反应氧化反应生成,反应③为G在Fe/HCl条件下硝基被还原生成,若反应②③两步不能互换,否则氨基会被氧化, 故答案为:不能;防止氨基被氧化; (3)B→C的化学方程式是:, 故答案为:; (4)的同分异构体中,①能发生银镜反应,说明分子中含有醛基;②含有苯环且分子中有四种不同化学环境的氢原子;③1mol该有机物最多能与2molNaOH反应,说明该有机物分子中1个酚羟基、1个羧基或含有2个酚羟基,满足体积的有机物如或, 故答案为:(或); (5)在催化剂条件下发生加成反应生成,再在氢氧化钠醇溶液、加热条件下发生消去反应生成,与氯气发生加成反应生成,最后在氢氧化钠水溶液中发生水解反应生成,合成反应流程图为: 故答案为:.查看更多