- 2021-07-02 发布 |
- 37.5 KB |
- 8页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019-2020学年江西省南昌市第十中学高一上学期期中考试化学试题
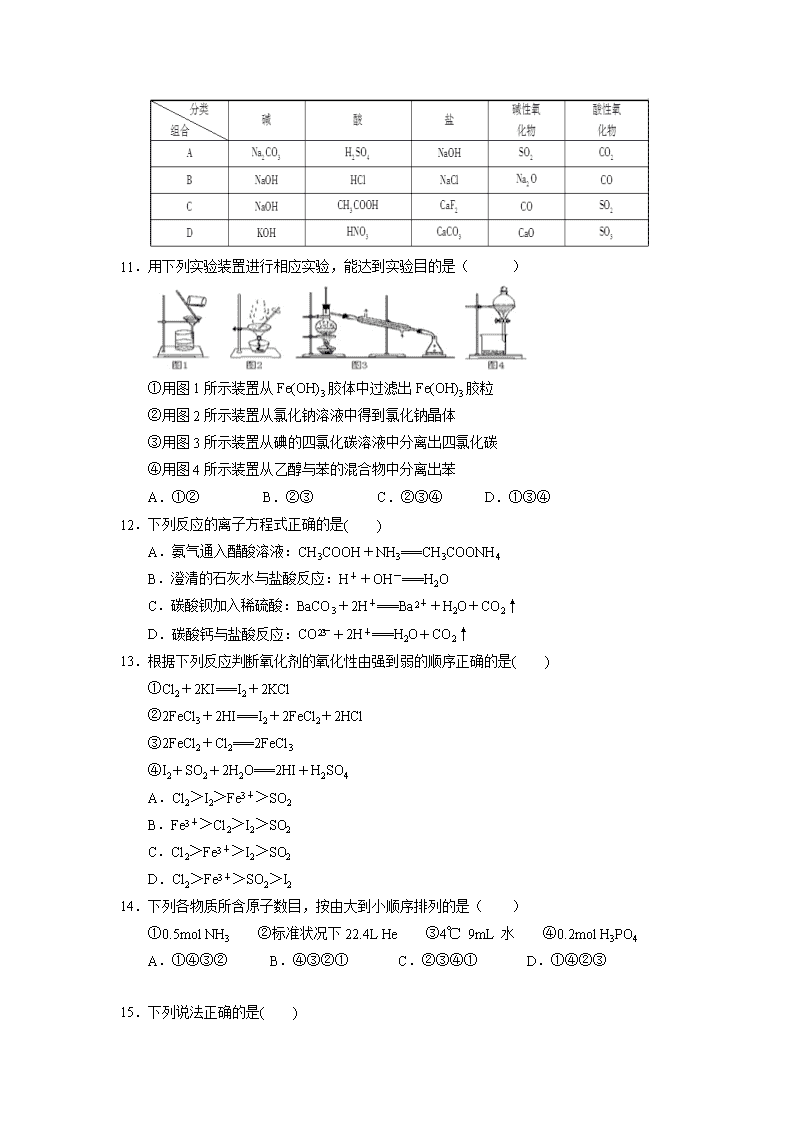
南昌十中2019—2020学年上学期期中考试 高 一 化 学 试 题 说明:本卷分第Ⅰ卷和第Ⅱ卷,全卷满分100分,考试时间100分钟 . 注 意 事 项: 考生在答题前请认真阅读本注意事项及各题答题要求。 1.答题前,请您务必将自己的姓名、准考证号或IS号用书写黑色字迹的0.5毫米签字笔填写在答题卡和答题纸上。 2.作答非选择题必须用书写黑色字迹的0.5毫米签字笔写在答题纸上的指定位置,在其它位置作答一律无效。作答选择题必须用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,请用橡皮擦干净后,再选涂其它答案,请保持卡面清洁和答题纸清洁,不折叠、不破损。 3.考试结束后,请将答题纸交回。 可能用到的相对原子质量:H:1 C:12 N:14 O:16 Mg:24 Cl:35.5 第Ⅰ卷(选择题 共48分) 一、选择题(本题包括16小题,每小题3分,共48分;每小题只有一个选项符合题意) 1.化学与生活、社会发展息息相关,下列说法不正确的是( ) A.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 B.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 C.“青蒿一握,以水二升渍,绞取汁”,诗句中体现的屠呦呦对青蒿素的提取属于化学变化 D.“春蚕到死丝方尽,蜡炬成灰泪始干” 诗句中涉及氧化还原反应 2.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( ) A.2.4g镁完全反应生成镁离子,失去的电子数目一定为0.1NA B.标准状况下,11.2L H2O含有的原子总数为1.5NA C.常温常压下,46 g NO2和N2O4的混合气体中含有原子总数为3NA D.17g氢氧根离子所含的电子数为9NA 3.下列变化必须加入还原剂才能实现的是( ) A.KClO3→KCl B.Fe3+→Fe2+ C.HCO3- →CO32- D.Cu→Cu2+ 4.下列各组离子中,在碱性溶液中能大量共存,且溶液为无色透明的是( ) A.K+、MnO、Cl-、SO B.Na+、CO、SO、Cl- C.NO、Na+、HCO、Ba2+ D.Na+、NO、H+、SO 5.下列反应中,既属于氧化还原反应,又属于离子反应的是( ) A.铝片与稀盐酸的反应 B.甲烷与氧气的反应 C.灼热的炭与二氧化碳反应生成一氧化碳 D.氢氧化钠溶液与稀盐酸的反应 6.单质X和单质Y反应生成X3+和Y2-,现有下列叙述: ①X被氧化;②X是氧化剂;③Y被氧化;④Y是氧化剂;⑤X表现还原性;⑥Y表现还原性。其中正确的是( ) A.①②⑤ B.①④⑥ C.①④⑤ D.①②⑥ 7.下列实验操作中错误的是( ) A.进行蒸发操作时,不能使混合物中的水分完全蒸干 B.进行蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 C.进行萃取操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 D.进行萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 8.在反应:6NO+4NH35N2+6H2O中,氧化产物与还原产物的物质的量之比为( ) A.1∶1 B.2∶3 C.3∶2 D.1∶3 9.下列关于物质检验的说法中正确的是( ) A.往某溶液中滴加BaCl2溶液,产生白色沉淀,则原溶液中一定含SO B.往某溶液中通入CO2,产生白色沉淀,则原溶液中一定含Ca2+ C.向某溶液中滴加稀盐酸,产生无色无味的气体,则原溶液中一定含有CO D.往某溶液中滴加Na2CO3溶液,若产生气体,则原溶液一定显酸性 10.关于物质分类正确的组合是( ) 11.用下列实验装置进行相应实验,能达到实验目的是( ) ①用图1所示装置从Fe(OH)3胶体中过滤出Fe(OH)3胶粒 ②用图2所示装置从氯化钠溶液中得到氯化钠晶体 ③用图3所示装置从碘的四氯化碳溶液中分离出四氯化碳 ④用图4所示装置从乙醇与苯的混合物中分离出苯 A.①② B.②③ C.②③④ D.①③④ 12.下列反应的离子方程式正确的是( ) A.氨气通入醋酸溶液:CH3COOH+NH3===CH3COONH4 B.澄清的石灰水与盐酸反应:H++OH-===H2O C.碳酸钡加入稀硫酸:BaCO3+2H+===Ba2++H2O+CO2↑ D.碳酸钙与盐酸反应:CO+2H+===H2O+CO2↑ 13.根据下列反应判断氧化剂的氧化性由强到弱的顺序正确的是( ) ①Cl2+2KI===I2+2KCl ②2FeCl3+2HI===I2+2FeCl2+2HCl ③2FeCl2+Cl2===2FeCl3 ④I2+SO2+2H2O===2HI+H2SO4 A.Cl2>I2>Fe3+>SO2 B.Fe3+>Cl2>I2>SO2 C.Cl2>Fe3+>I2>SO2 D.Cl2>Fe3+>SO2>I2 14.下列各物质所含原子数目,按由大到小顺序排列的是( ) ①0.5mol NH3 ②标准状况下22.4L He ③4℃ 9mL 水 ④0.2mol H3PO4 A.①④③② B.④③②① C.②③④① D.①④②③ 15.下列说法正确的是( ) A.同温同压下质量相同的O2和O3的原子数之比是2:3 B.20 ℃、1.0×105Pa时,同体积的O2与CO2含有相同的分子数 C.当1 mol气态物质的体积为22.4 L时,该气体一定处于标准状况 D.5.6gCO和22.4LCO2中含有的碳原子数一定相等。 16.在反应X+2Y===R+2M中,已知R和M的摩尔质量之比为22∶9,当1.6 g X与Y完全反应后,生成4.4 g R。则在此反应中Y和M的质量之比为( ) A.16∶9 B.23∶9 C.32∶9 D.46∶9 第Ⅱ卷(非选择题 共52分) 二、非选择题(本题包括6小题,共52分) 17.(10分)现有下列七种物质:①铝 ②蔗糖 ③CO2 ④H2SO4 ⑤Ba(OH)2 ⑥红褐色的氢氧化铁胶体 ⑦HCl ⑧冰水混合物 ⑨碳酸钙 ⑩CuSO4·5H2O。 (1)上述物质中属于电解质的有__________(填序号)。 (2)向⑥的溶液中逐渐滴加⑦的溶液,看到的现象是________________________。 (3)上述物质中有两种物质在水溶液中发生反应,其离子方程式为:H++OH-=H2O,则该反应的化学方程式为______________________________。 (4)书写下列反应的离子方程式: ①将NH4Cl溶液和NaOH溶液混合: ②醋酸溶液和NaHCO3溶液混合: 18.(13分)(1)写出NaHSO4在水中的电离方程式_____ 。 (2)粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,要除去这些杂质,可选用以下试剂:①Na2CO3、②NaOH、③BaCl2、④HCl ,则试剂加入的先后顺序是_____ (填序号)。 (3)2KMnO4+16HCl(浓) ===2KCl+2MnCl2+5Cl2↑+8H2O 用双线桥法标出该反应电子转移的方向和数目_________________ 若有0.1 mol电子转移时生成Cl2的体积为________________(标准状况),被氧化的HCl的物质的量为______________。 (4)某无色透明溶液可能含有K+、Cu2+、Ca2+、、、Cl﹣中的几种,现进行如下实验: ①滴加BaCl2溶液,有白色沉淀产生,将沉淀滤出。 ②向上述沉淀中加入足量的稀硝酸,有部分沉淀溶解。 ③向滤液加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀HNO3。 试判断:该溶液中肯定有 ,肯定没有 ,可能有 (填离子符号)。 19.(9分)某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性,回答下列问题: (1)写出装置A中所发生反应的离子方程式:________________________________。 (2)装置B中最适宜的试剂是____________________________________________。 (3)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是 ________________________________________________________________________ ________________________________________________________________________ (4)根据实验中的________________________________________________现象, 可证明CO具有还原性. (5)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置________与______之间连接下图中的________装置(填序号)。 20.(8分)食盐是人类生活中不可缺少的物质,海水中含有大量食盐。 某地出产的粗盐中,所含杂质是CaCl2,通过下面的实验可制得纯净的NaCl。 请回答: (1)加入的A是__________,检验A已过量的方法是_________________________ ___________________________________________________________________ (2)加入的B是__________,加入稍过量B的目的是________________________。 (3)为检验沉淀是否洗净,取最后一次洗涤液加入______________________溶液。 21.(6分)下列四个反应 ①2Na+2H2O===2NaOH+H2↑ ②2F2+2H2O===4HF+O2 ③Cl2+H2O===HCl+HClO ④C+H2O(g)CO+H2 试从氧化还原的角度,回答下列问题: (1)水只作还原剂的是__________________(填序号) (2)二氧化氯(ClO2)是一种在水处理方面有广泛应用的高效安全消毒剂,而且不会产生对人体有潜在危害的物质。工业上可以用如下方法制备ClO2:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O。 反应中氧化剂是_____ _,生成1.25mol氧化产物共转移电子 mol。 写出该反应的离子方程式 。 22.(6分)计算 (1)0.3 mol NH3分子中所含原子数与________ 个H2O分子中所含原子数相等。 (2)在9.5 g某二价金属的氯化物中含有0.2 mol Cl-,该金属元素的相对原子质量为________ 。 (3)在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,此混合物中C和O原子个数比是_______ 。 答案 C C B D A C D B D D B B C A B A 17. (10分)(1)④⑤⑦⑧⑨⑩ (2分) (2) 开始产生红褐色沉淀,后来沉淀溶解消失 (2分) (3)Ba(OH)2+2HCl=BaCl2+2H2O (2分) (4) ①NH4+ + OH— = NH3•H2O (2分) ②CH3COOH +HCO3 — = CH3COO— + H2O +CO2↑ (2分) 18 (13分) (1) NaHSO4=Na++H++SO42- (1分) (2) ②③①④或③②①④ 或③①②④ (2分) (3) (2分) 1.12L(2分) 0.1mol (2分) (4)K+、、(2分) Cu2+、Ca2+ (1分) Cl﹣(1分) 19.(9分)(1)CaCO3+2H+===Ca2++H2O+CO2↑(2分) (2)饱和碳酸氢钠溶液 (1分) (3)没有除去气体中的水蒸气,高温下水蒸气与炭反应生成H2和CO,H2也能还原CuO(2分) (4)E装置中黑色CuO变成红色(1分) (5)D (1分) E(1分) ②(1分) 20.(8分)(1)Na2CO3 (1分)在上层清液中继续滴加Na2CO3溶液,若不再有沉淀,则加Na2CO3溶液已过量 (2分) (2)盐酸(1分) 除尽溶液中过量的Na2CO3(2分)(3)HNO3酸化的AgNO3(2分) 21.(6分)(1)②(1分)(2)NaClO3 (1分) 2.5(2分) 2ClO3—+H2O2+2H+===2ClO2↑+O2↑+2H2O (2分) 22.(1)2.408×1023 (2分) (2)24 (2分) (3)4∶7 (2分)查看更多