- 2021-07-02 发布 |
- 37.5 KB |
- 13页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2020届一轮复习人教版水溶液中的离子平衡作业
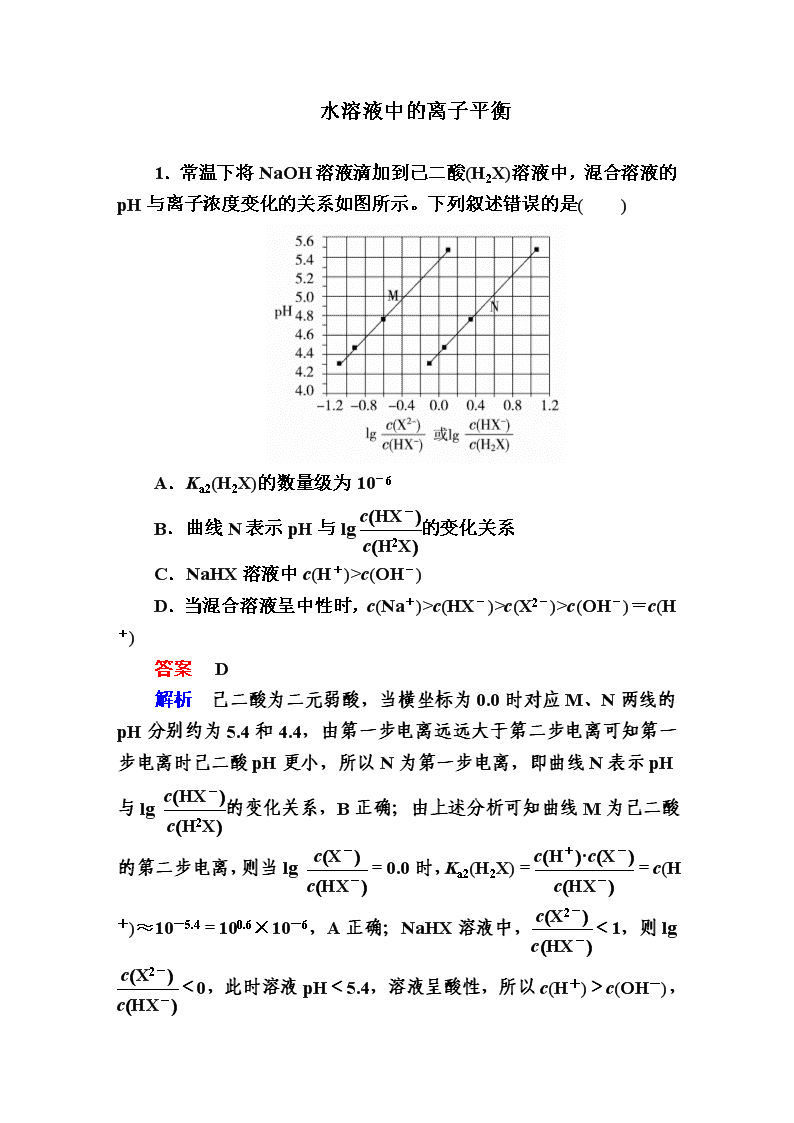
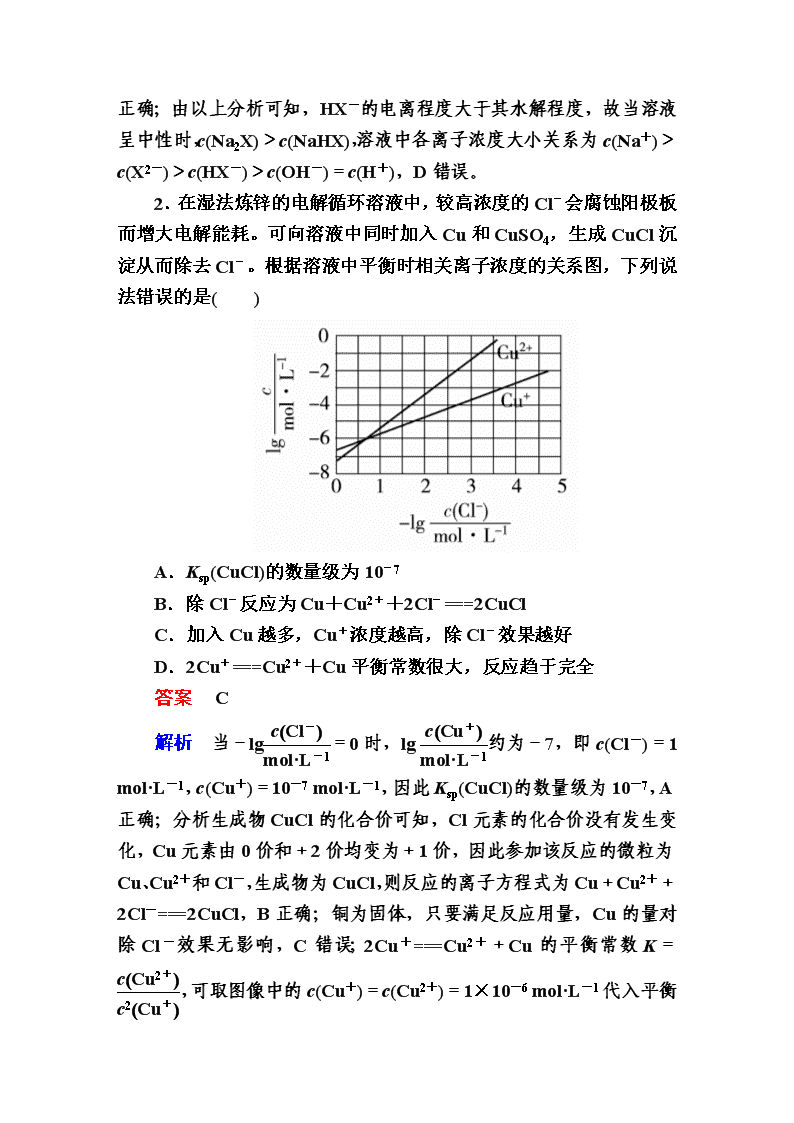
水溶液中的离子平衡 1.常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( ) A.Ka2(H2X)的数量级为10-6 B.曲线N表示pH与lg的变化关系 C.NaHX溶液中c(H+)>c(OH-) D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+) 答案 D 解析 己二酸为二元弱酸,当横坐标为0.0时对应M、N两线的pH分别约为5.4和4.4,由第一步电离远远大于第二步电离可知第一步电离时己二酸pH更小,所以N为第一步电离,即曲线N表示pH与lg 的变化关系,B正确;由上述分析可知曲线M为己二酸的第二步电离,则当lg =0.0时,Ka2(H2X)==c(H+)≈10-5.4=100.6×10-6,A正确;NaHX溶液中,<1,则lg<0,此时溶液pH<5.4,溶液呈酸性,所以c(H+)>c(OH-),C正确;由以上分析可知,HX- 的电离程度大于其水解程度,故当溶液呈中性时,c(Na2X)>c(NaHX),溶液中各离子浓度大小关系为c(Na+)>c(X2-)>c(HX-)>c(OH-)=c(H+),D错误。 2.在湿法炼锌的电解循环溶液中,较高浓度的Cl-会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去Cl-。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( ) A.Ksp(CuCl)的数量级为10-7 B.除Cl-反应为Cu+Cu2++2Cl-===2CuCl C.加入Cu越多,Cu+浓度越高,除Cl-效果越好 D.2Cu+===Cu2++Cu平衡常数很大,反应趋于完全 答案 C 解析 当-lg=0时,lg约为-7,即c(Cl-)=1 mol·L-1,c(Cu+)=10-7 mol·L-1,因此Ksp(CuCl)的数量级为10-7,A正确;分析生成物CuCl的化合价可知,Cl元素的化合价没有发生变化,Cu元素由0价和+2价均变为+1价,因此参加该反应的微粒为Cu、Cu2+和Cl-,生成物为CuCl,则反应的离子方程式为Cu+Cu2++2Cl-===2CuCl,B正确;铜为固体,只要满足反应用量,Cu的量对除Cl-效果无影响,C错误;2Cu+===Cu2++Cu的平衡常数K=,可取图像中的c(Cu+)=c(Cu2+)=1×10-6 mol·L-1代入平衡常数的表达式中计算,即K= =1×106 L·mol-1>105,因此平衡常数很大,反应趋于完全,D正确。 3.(双选)常温下,Ka(HCOOH)=1.77×10-4,Ka(CH3COOH)=1.75×10-5,Kb(NH3·H2O)=1.76×10-5,下列说法正确的是( ) A.浓度均为0.1 mol·L-1的HCOONa和NH4Cl溶液中阳离子的物质的量浓度之和:前者大于后者 B.用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等 C.0.2 mol·L-1 HCOOH与0.1 mol·L-1 NaOH等体积混合后的溶液中:c(HCOO-)+c(OH-)=c(HCOOH)+c(H+) D.0.2 mol·L-1 CH3COONa与0.1 mol·L-1盐酸等体积混合后的溶液中(pH<7):c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) 答案 AD 解析 相同浓度的HCOONa和NH4Cl溶液,水解程度NH大于HCOO-,根据电荷守恒c(Na+)+c(H+)=c(HCOO-)+c(OH-),c(NH)+c(H+)=c(Cl-)+c(OH-),可比较c(Na+)+c(H+)和c(Cl-)+c(OH-),c(Na+)=c(Cl-),又根据NH和HCOO-的水解程度得HCOONa中的c(H+)大于NH4Cl溶液中c(OH-),所以阳离子浓度之和,前者大于后者,A正确;用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液,因为CH3COOH的酸性弱于HCOOH,CH3COOH消耗NaOH溶液的体积比HCOOH的大,B错误;根据电荷守恒c(HCOO-)+c(OH-)=c(Na+)+c(H+),c(Na+)>c(HCOOH),C错误;反应后溶液相当于相同浓度的CH3COOH、CH3COONa、NaCl溶液的混合物,溶液显酸性,c(CH3COO-)>0.05 mol·L-1,c(CH3COOH)<0.05 mol·L-1,c(Cl-)=0.05 mol·L-1,c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+),D正确。 4.室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1 mol·L-1 的三种酸(HA、HB和HD)溶液,滴定曲线如图所示,下列判断错误的是( ) A.三种酸的电离常数关系:KHA>KHB>KHD B.滴定至P点时,溶液中:c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-) C.pH=7时,三种溶液中:c(A-)=c(B-)=c(D-) D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH-)-c(H+) 答案 C 解析 浓度均为0.1 mol·L-1的HA、HB和HD三种酸溶液的pH不同,pH越小,则酸的电离常数越大,A正确;滴定至P点时,所得溶液为等物质的量浓度的HB与NaB的混合溶液,溶液显酸性,说明HB的电离程度强于B-的水解程度,故c(B-)>c(Na+)>c(HB)>c(H+)>c(OH-),B正确;pH=7时,三种溶液中:c(A-)>c(B-)>c(D-),C错误;根据质子守恒知D正确。 5.(双选)H2C2O4为二元弱酸。20 ℃时,配制一组c(H2C2O4)+c(HC2O)+c(C2O)=0.100 mol·L-1的H2C2O4和NaOH混合溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列指定溶液中微粒的物质的量浓度关系一定正确的是( ) A.pH=2.5的溶液中:c(H2C2O4)+c(C2O)>c(HC2O) B.c(Na+)=0.100 mol·L-1的溶液中:c(H+)+c(H2C2O4)=c(OH-)+c(C2O) C.c(HC2O)=c(C2O)的溶液中:c(Na+)>0.100 mol·L-1+c(HC2O) D.pH=7.0的溶液中:c(Na+)>2c(C2O) 答案 BD 解析 由题图知pH=2.5时,c(HC2O)>0.08 mol·L-1,则c(C2O)+c(H2C2O4)<0.02 mol·L-1,A错误;当c(Na+)=0.100 mol·L-1时,溶液的溶质恰好为NaHC2O4,依据质子守恒知,B正确;依据电荷守恒:c(Na+)+c(H+)=c(HC2O)+2c(C2O)+c(OH-),又c(HC2O)+c(C2O)+c(H2C2O4)=0.100 mol·L-1,c(HC2O)=c(C2O),故2c(C2O)=0.100 mol·L-1-c(H2C2O4),c(Na+)+c(H+)=0.100 mol·L-1-c(H2C2O4)+c(HC2O)+c(OH-),c(Na+)=0.100 mol·L-1+c(HC2O)-{c(H2C2O4+[c(H+)-c(OH-)]},因为c(H2C2O4)>0,由题图知c(H+)-c(OH-)>0,则c(Na+)<0.100 mol·L-1+c(HC2O),C错误;由电荷守恒知,c(Na+)+c(H+)=c(HC2O)+2c(C2O)+c(OH-),pH=7.0时有:c(Na+)=c(HC2O)+2c(C2O),c(Na+)>2c(C2O),D正确。 6.苯甲酸钠(,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A-。已知25 ℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11。在生产碳酸饮料的过程中,除了添加NaA外,还需加压充入CO2气体。下列说法正确的是(温度为25 ℃,不考虑饮料中其他成分)( ) A.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低 B.提高CO2充气压力,饮料中c(A-)不变 C.当pH为5.0时,饮料中=0.16 D.碳酸饮料中各种粒子的浓度关系为:c(H+)=c(HCO)+c(CO)+c(OH-)-c(HA) 答案 C 解析 根据题中所给的电离平衡常数可知,酸性:HA>H2CO3>HCO。碳酸饮料因充有CO2而使HA的电离受到抑制,故相比于未充CO2的饮料,碳酸饮料中HA的浓度较大,抑菌能力较强,A错误;提高CO2充气压力,CO2的溶解度增大,HA的电离平衡左移,c(A-)减小,B错误;因为HAH++A-,Ka=c(H+)·c(A-)/c(HA),故c(HA)/c(A-)=c(H+)/Ka=10-5/(6.25×10-5)=0.16,C正确;依据溶液中电荷守恒可知:c(Na+)+c(H+)=c(HCO)+2c(CO)+c(OH-)+c(A-),结合物料守恒:c(Na+)=c(A-)+c(HA),所以,c(H+)=c(HCO)+2c(CO)+c(OH-)-c(HA),D错误。 7.室温下向10 mL 0.1 mol·L-1 NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。下列说法正确的是( ) A.a点所示溶液中c(Na+)>c(A-)>c(H+)>c(HA) B.a、b两点所示溶液中水的电离程度相同 C.pH=7时,c(Na+)=c(A-)+c(HA) D.b点所示溶液中c(A-)>c(HA) 答案 D 解析 加入10 mL一元酸HA溶液时,恰好中和,但溶液的pH为8.7,说明HA为弱酸,a点表示NaA溶液,A-+H2OHA+OH-,存在A-的水解溶液显碱性,应有c(Na+)>c(A-)>c(OH-)>c(HA)>c(H+),A错误;a点水的电离受到促进,b点为等物质的量浓度的NaA和HA的混合溶液,溶液呈酸性的原因是HA的电离程度大于A-的水解程度,故c(A-)>c(HA),总的来看水的电离受到了抑制,B错误,D正确;由溶液中电荷守恒可知c(Na+)+c(H+)=c(A-)+c(OH-),溶液呈中性,即c(H+)=c(OH-),则可知c(Na+)=c(A-),C错误。 8.室温下,将0.05 mol Na2CO3固体溶于水配成100 mL溶液,向溶液中加入下列物质,有关结论正确的是( ) 答案 B 解析 0.05 mol Na2CO3与50 mL 1 mol·L-1 H2SO4恰好完全反应生成Na2SO4,c(Na+)=2c(SO),A错误;0.05 mol Na2CO3与0.05 mol CaO二者完全反应:Na2CO3+CaO+H2O===CaCO3↓+2NaOH,原Na2CO3溶液中:CO+H2OHCO+OH-平衡逆向移动,使c(HCO)减小,溶液中c(OH-)增大,二者比值增大,B正确;在碳酸钠溶液中加水,CO的水解程度增大,但由水电离出的c(H+)·c(OH-)将减小,C错误;在碳酸钠溶液中加入NaHSO4固体,溶液中c(Na+)必然增大,D错误。 9.下列曲线中,可以描述乙酸(甲,Ka=1.8×10-5)和一氯乙酸(乙,Ka=1.4×10-3)在水中的电离度与浓度关系的是( ) 答案 B 解析 根据乙酸和一氯乙酸的电离常数可判断一氯乙酸酸性大于乙酸,即两酸浓度相同时,一氯乙酸电离度大于乙酸,且弱酸的浓度越大,其电离度越小,B正确。 10.(1)为测定产品(无水MgBr2)的纯度,可用EDTA(简写为Y4-)标准溶液滴定,反应的离子方程式:Mg2++Y4-===MgY2- ①滴定前润洗滴定管的操作方法是 ________________________________________________________________________________________________________________________________________________。 ②测定前,先称取0.2500 g无水MgBr2产品,溶解后,用0.0500 mol·L-1的EDTA标准溶液滴定至终点,消耗EDTA标准溶液26.50 mL,则测得无水MgBr2产品的纯度是________(以质量分数表示)。 (2)利用间接酸碱滴定法可测定Ba2+的含量,实验分两步进行。 已知:2CrO+2H+===Cr2O+H2O; Ba2++CrO===BaCrO4↓。 步骤Ⅰ:移取x mL一定浓度的Na2CrO4溶液于锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V0 mL。 步骤Ⅱ:移取y mL BaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1 mL。 滴加盐酸标准液时应使用酸式滴定管,“0”刻度位于滴定管的________(填“上方”或“下方”)。BaCl2溶液的浓度为________mol·L-1。若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将________(填“偏大”或“偏小”)。 (3)若酸性FeCl2废液中c(Fe2+)=2.0×10-2 mol·L-1,c(Fe3+)=1.0×10-3 mol·L-1,c(Cl-)=5.3×10-2 mol·L-1,则该溶液的pH约为________________。 (4)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下: 已知:滴定时反应的化学方程式为SO2+I2+2H2O===H2SO4+2HI ①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________g·L-1。 ②在上述实验过程中,若有部分HI被空气氧化,则测定结果________(填“偏高”“偏低”或“不变”)。 答案 (1)①从滴定管上口加入少量待装液,倾斜着转动滴定管,使液体润湿内壁,然后从下部放出,重复2~3次 ②97.5% (2)上方 偏大 (3)2 (4)①0.16 ②偏低 解析 (1)②n(EDTA)=n(MgBr2)=26.50 mL×0.0500 mol·L-1×10-3 L·mL-1=0.001325 mol, m(MgBr2)=0.001325 mol×184 g·mol-1=0.2438 g,纯度为×100%≈97.5%。 (2)由关系式:CrO~H+、CrO~Ba2+可知,与Ba2+结合生成BaCrO4沉淀的Na2CrO4的物质的量等于(V0-V1) mL盐酸中HCl的物质的量,故BaCl2溶液的浓度为。若步骤Ⅱ中滴加盐酸时有少量待测液溅出,则步骤Ⅱ中测得滴加盐酸的体积偏小,导致Ba2+浓度测量值偏大。 (3)根据电荷守恒: 2c(Fe2+)+3c(Fe3+)+c(H+)=c(Cl-) c(H+)=c(Cl-)-2c(Fe2+)-3c(Fe3+)=5.3×10-2 mol·L-1-2×2.0×10-2 mol·L-1-3×1.0×10-3 mol·L-1=1.0×10-2 mol·L-1,pH=-lg c(H+)=2。 (4)①100.00 mL葡萄酒样品中抗氧化剂的残留量n(SO2)=n(I2)=0.01000 mol·L-1×25.00×10-3 L=2.5×10-4 mol,则1 L样品中抗氧化剂的残留量为2.5×10-4 mol×10×64 g·mol-1=0.16 g。 ②若有部分HI被氧化,则实验过程中消耗标准I2溶液偏少,测定结果会偏低。 11.(1)联氨为二元弱碱,在水中的电离方式与氨相似。联氨第一步电离反应的平衡常数值为________(已知:N2H4+H+N2H的K=8.7×107;Kw=1.0×10-14)。联氨与硫酸形成的酸式盐的化学式为____________________。 (2)氨是合成硝酸、铵盐和氮肥的基本原料。回答下列问题: 氨的水溶液显弱碱性,其原因为__________________(用离子方程式表示);0.1 mol·L-1的氨水中加入少量NH4Cl固体,溶液的pH________(填“升高”或“降低”);若加入少量明矾,溶液中NH的浓度________(填“增大”或“减小”)。 (3) 25 ℃,两种酸的电离平衡常数如表。 Ka1 Ka2 H2SO3 1.3×10-2 6.3×10-8 H2CO3 4.2×10-7 5.6×10-11 ①HSO的电离平衡常数表达式K=________。 ②0.10 mol·L-1 Na2SO3溶液中离子浓度由大到小的顺序为__________________________。 ③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为____________________________________。 (4)①H3PO2是一元中强酸,写出其电离方程式______________________________。 ②NaH2PO2为________(填“正盐”或“酸式盐”),其溶液显________(填“弱酸性”“中性”或“弱碱性”)。 答案 (1)8.7×10-7 N2H6(HSO4)2 (2)NH3·H2ONH+OH- 降低 增大 (3)① ②c(Na+)>c(SO)>c(OH-)>c(HSO)>c(H+)(或[Na+]>[SO]>[OH-]>[HSO]>[H+]) ③H2SO3+HCO===HSO+CO2↑+H2O (4)①H3PO2H++H2PO ②正盐 弱碱性 解析 (1)N2H4的第一步电离的方程式为N2H4+H2ON2H+OH-,则电离常数Kb= == =K·Kw=8.7×107×1.0×10-14=8.7×10-7。联氨是二元弱碱,其与硫酸形成的酸式盐为N2H6(HSO4)2。 (2)氨气溶于水生成一水合氨,一水合氨为弱电解质,它部分电离产生NH和OH-,使溶液显碱性;若加入少量氯化铵固体,则铵根离子浓度增大,使一水合氨的电离平衡逆向移动,c(OH-)减小,pH降低;若加入少量明矾,因Al3+与OH-反应,使一水合氨的电离平衡正向移动,则c(NH)增大。 (3)①HSOH++SO,其电离平衡常数表达式K= 。②Na2SO3溶液由于SO水解而呈碱性,离子浓度大小顺序为c(Na+)>c(SO)>c(OH-)>c(HSO)>c(H+)。③由于H2SO3的Ka2小于H2CO3的Ka1,则H2SO3溶液与NaHCO3溶液反应后H2SO3转化为HSO而不是SO,离子方程式为H2SO3+HCO===HSO+H2O+CO2↑。 (4)①因为H3PO2是一元中强酸,只有部分发生电离,电离方程式为H3PO2H++H2PO。 ②根据H3PO2是一元中强酸,可以判断NaH2PO2是正盐,属于弱酸强碱盐,因H2PO水解而使溶液呈弱碱性。查看更多