2020届高考化学一轮复习位_构_性”的综合推断作业
建议用时:40分钟
一、选择题
1.W、X、Y、Z均为短周期元素,W的最外层电子数与核外电子总数之比为7∶17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;Z与W位于同周期,它们能形成ZW型离子化合物,下列判断正确的是( )
A.氢化物的稳定性:HnX
Y>Z>X
C.离子的还原性:X>W
D.原子半径:Y>Z>X
答案 B
解析 依题意知,W为Cl;X与W同主族,则X为F;F与Cl的原子序数之和为26,则Y为Al,Z与W(Cl)都在第三周期,且它们形成ZW型离子化合物,则Z为Na。即它们在周期表的相对位置为:
逐项分析:A应为HnX>HnW,错误;B正确;C应为XY>X,错误。
2.X和Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径;Z和Y两元素的原子核外电子层数相同,Z元素的原子半径小于Y元素的原子半径。X、Y、Z三种元素的原子序数的关系是( )
A.X>Y>Z B.Y>X>Z
C.Z>X>Y D.Z>Y>X
答案 D
解析 根据题意,X元素的阳离子半径大于Y元素的阳离子半径,则X的原子序数小于Y的原子序数;Z和Y元素的原子核外电子层数相同,且Z元素的原子半径小于Y元素的原子半径,则Z元素的原子序数大于Y元素的原子序数。由此得出三种元素原子序数的关系为Z>Y>X。
3.短周期主族元素X、Y、Z在元素周期表中的相对位置如图所示。下列说法一定正确的是( )
A.最高正化合价:Z>X
B.X、Y、Z的单质中,Z的熔点最高
C.若X为非金属元素,则离子半径:Xn->Ym->Zm-
D.若X为金属元素,则X、Y、Z的最高价氧化物对应水化物中,Y的碱性最强
答案 C
解析 一般情况下,元素的最高正化合价与其族序数相等,但O、F无正化合价,Z为O或F时不符合题意,A项错误;若X为Si,则三者的单质中,Si的熔点最高,B项错误;若X为非金属元素,则Xn-、Ym-具有相同电子层结构,核电荷数越小,离子半径越大,故离子半径:Xn->Ym-,而Y与Z同主族,离子半径:Ym->Zm-,C项正确;X、Y、Z中X的金属性最强,故X的最高价氧化物对应水化物的碱性最强,D项错误。
4.短周期元素X、Y、Z、W,它们的原子序数依次增大。X与Z同主族,并且原子序数之和为20。Y原子的质子数为Z原子的质子数的一半,W原子的最外层电子数比Y原子的最外层电子数多2个。下列叙述正确的是( )
A.Y的最高价氧化物对应的水化物可与其简单气态氢化物发生反应
B.原子半径:Z>W>Y>X
C.简单气态氢化物的稳定性:Z>W
D.X的简单气态氢化物与足量W的单质在光照条件下反应的生成物均为气体
答案 A
解析 在短周期元素中,C、Si的原子序数之和为6+14=20[或设X的原子序数为a,则Z的原子序数为a+8,有a+(a+8)=20,解得a=6],即X为C,Z为Si。Y原子的质子数为7,则Y为N。N原子最外层电子数为5,则W原子最外层电子数为7,W为Cl。
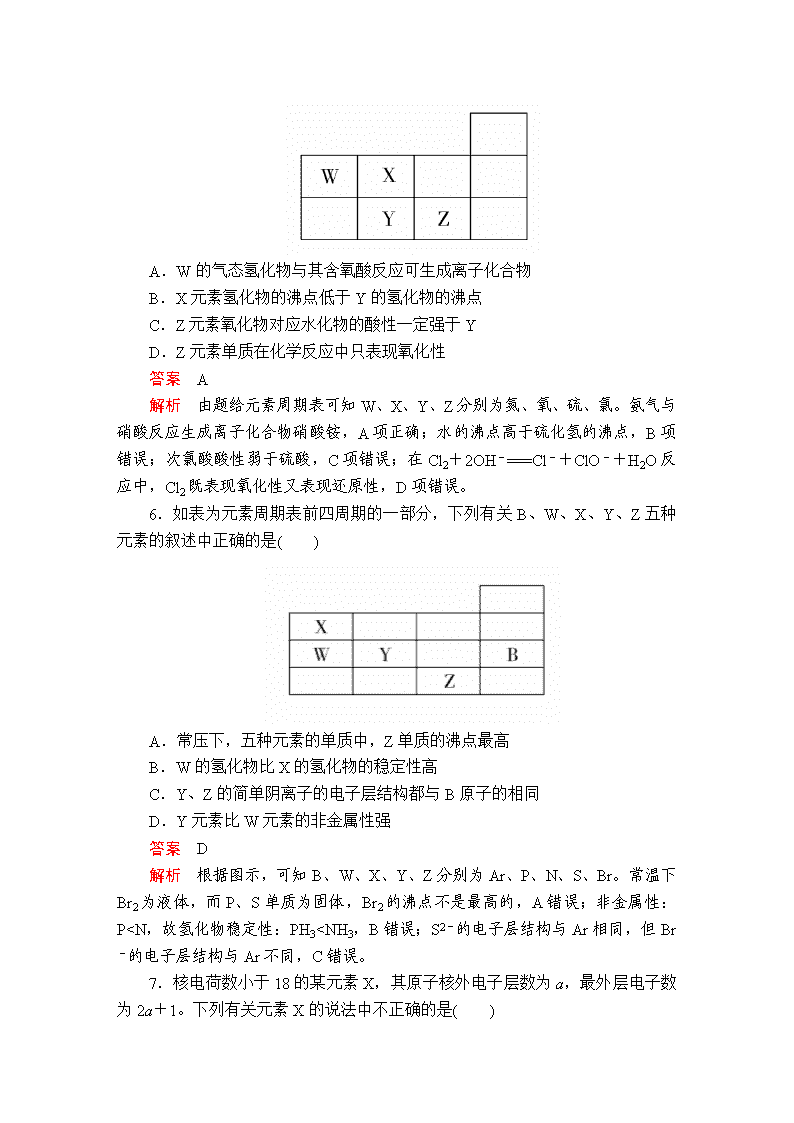
5.W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,下列说法正确的是( )
A.W的气态氢化物与其含氧酸反应可生成离子化合物
B.X元素氢化物的沸点低于Y的氢化物的沸点
C.Z元素氧化物对应水化物的酸性一定强于Y
D.Z元素单质在化学反应中只表现氧化性
答案 A
解析 由题给元素周期表可知W、X、Y、Z分别为氮、氧、硫、氯。氨气与硝酸反应生成离子化合物硝酸铵,A项正确;水的沸点高于硫化氢的沸点,B项错误;次氯酸酸性弱于硫酸,C项错误;在Cl2+2OH-===Cl-+ClO-+H2O反应中,Cl2既表现氧化性又表现还原性,D项错误。
6.如表为元素周期表前四周期的一部分,下列有关B、W、X、Y、Z五种元素的叙述中正确的是( )
A.常压下,五种元素的单质中,Z单质的沸点最高
B.W的氢化物比X的氢化物的稳定性高
C.Y、Z的简单阴离子的电子层结构都与B原子的相同
D.Y元素比W元素的非金属性强
答案 D
解析 根据图示,可知B、W、X、Y、Z分别为Ar、P、N、S、Br。常温下Br2为液体,而P、S单质为固体,Br2的沸点不是最高的,A错误;非金属性:PW>Z,A项错误。Y、Z元素在自然界中不能以游离态存在,但W元素(即硫)可以以单质形式存在,B项错误。WX3(SO3)是分子晶体,汽化时需克服分子间作用力,YX2(SiO2)是原子晶体,熔化时需要破坏共价键,C项错误。As位于元素周期表中第四周期、第ⅤA族,是金属元素区与非金属元素区的交界处,故As的单质具有半导体特性;根据同周期元素最高、最低化合价递变规律,As的最高化合价是+5,最低化合价是-3,As2O3中As的化合价是+3,则As2O3具有氧化性和还原性,D项正确。
9.(2018·齐齐哈尔市二模)a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与电子层数相同,b的最高和最低化合价的代数和为0,c的最高价氧化物对应的水化物为强碱,d与b同族。下列叙述错误的是( )
A.原子半径:aY>Z
B.气态氢化物的热稳定性:Y>X
C.最高价氧化物对应水化物的酸性:M>Z
D.由R、X、Y、M四种元素组成的盐只有一种
答案 D
解析 依题意,题述五种主族元素占据三个短周期,R的原子序数最小,则R为H。若Y有1个电子层,则Y原子最外层有3个电子,不符合原子核外电子排布规则;若Y有2个电子层,则最外层有6个电子,Y为O,符合题意;若Y有3个电子层,则最外层有9个电子,不符合原子核外电子排布规则。综上所述,Y为O。Y和M同主族,M为S。观察题图知,Q含有金属阳离子,且该金属阳离子与碱反应生成的氢氧化物难溶于水,而该氢氧化物又能与碱反应,所以,Q含有铝离子。分析题图,当加入氢氧化钠溶液的体积由3 mL→4 mL时,生成沉淀的物质的量不变,说明铵根离子与碱反应。由原子序数大小知,X为N,Z为Al。S2-、O2-、Al3+的半径依次减小,A项正确;热稳定性:H2O>NH3,B项正确;酸性:H2SO4>Al(OH)3,C项正确;H、N、O、S四种元素组成的盐有NH4HSO4、(NH4)2SO4、NH4HSO3、(NH4)2SO3、(NH4)2S2O3等,D项错误。
二、非选择题
13.短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体。回答下列问题:
(1)M元素位于周期表中的第________周期第________族。
(2)Z元素是________,其在自然界中常见的二元化合物是________。
(3)X与M的单质在高温下反应的化学方程式为________________,产物分子为直线形,其化学键属________共价键(填“极性”或“非极性”)。
(4)四种元素中的________可用于航空航天合金材料的制备,其单质与稀盐酸反应的化学方程式为________________________。
答案 (1)三 ⅥA (2)Si SiO2 (3)C+2SCS2 极性 (4)Mg Mg+2HCl===MgCl2+H2↑
解析 短周期元素X、Y、Z、M的原子序数依次增大,元素X的一种高硬度单质是宝石,则X是C元素;Y2+电子层结构与氖相同,则Y是Mg元素;Z的质子数为偶数,室温下M单质为淡黄色固体,则Z是Si元素,M是S元素。
(1)M元素是S元素,其原子结构示意图为,所以位于周期表中的第三周期第ⅥA族。
(2)Z元素是Si元素,其在自然界中常见的二元化合物是SiO2。
(3)X与M的单质在高温下反应产生CS2,该反应的化学方程式为C+2SCS2,产物分子为直线形,结构与CO2类似,由于是不同元素的原子形成的共价键,所以其化学键属极性共价键。
(4)四种元素中只有Mg是金属元素,密度比较小,制成的合金硬度大,所以可用于航空航天合金材料的制备,该金属是比较活泼的金属,可以与盐酸发生置换反应产生氢气,其单质与稀盐酸反应的化学方程式为Mg+2HCl===MgCl2+H2↑。
14.(2018·天津一中月考)A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E同主族。
(1)B在周期表中的位置为第________周期第________族。
(2)E元素形成的氧化物对应的水化物的化学式为________________。
(3)元素B、C、D、E形成的简单离子半径大小关系是____________________(用离子符号表示)。
(4)用电子式表示化合物D2C的形成过程:____________________。
(5)由A、B、C三种元素形成的离子化合物的化学式为________,它与强碱溶液共热,发生反应的离子方程式是______________________________。
(6)D2EC3一定条件下可以发生分解反应生成两种盐,其中一种产物为无氧酸盐,则此反应的化学方程式为_______________(化学式用具体的元素符号表示)。
答案 (1)二 ⅤA
(2)H2SO3、H2SO4
(3)S2->N3->O2->Na+
(4)
(5)NH4NO3 NH+OH-NH3↑+H2O
(6)4Na2SO3Na2S+3Na2SO4
解析 A元素的原子核内只有1个质子,则A为H元素;B的最高价氧化物对应水化物的化学式为HBO3,则B的最高化合价为+5价,位于周期表第ⅤA族,B元素的原子半径是其所在主族中最小的,应为N元素;C元素原子的最外层电子数比次外层多4个,只能有2个电子层,最外层电子数为6,应为O元素;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C,则D的化合价为+1价,D为Na元素;C、E同主族,则E为S元素。