- 2021-07-02 发布 |
- 37.5 KB |
- 6页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
化学卷·2018届黑龙江省齐齐哈尔市第八中学高二上学期期末考试(2017
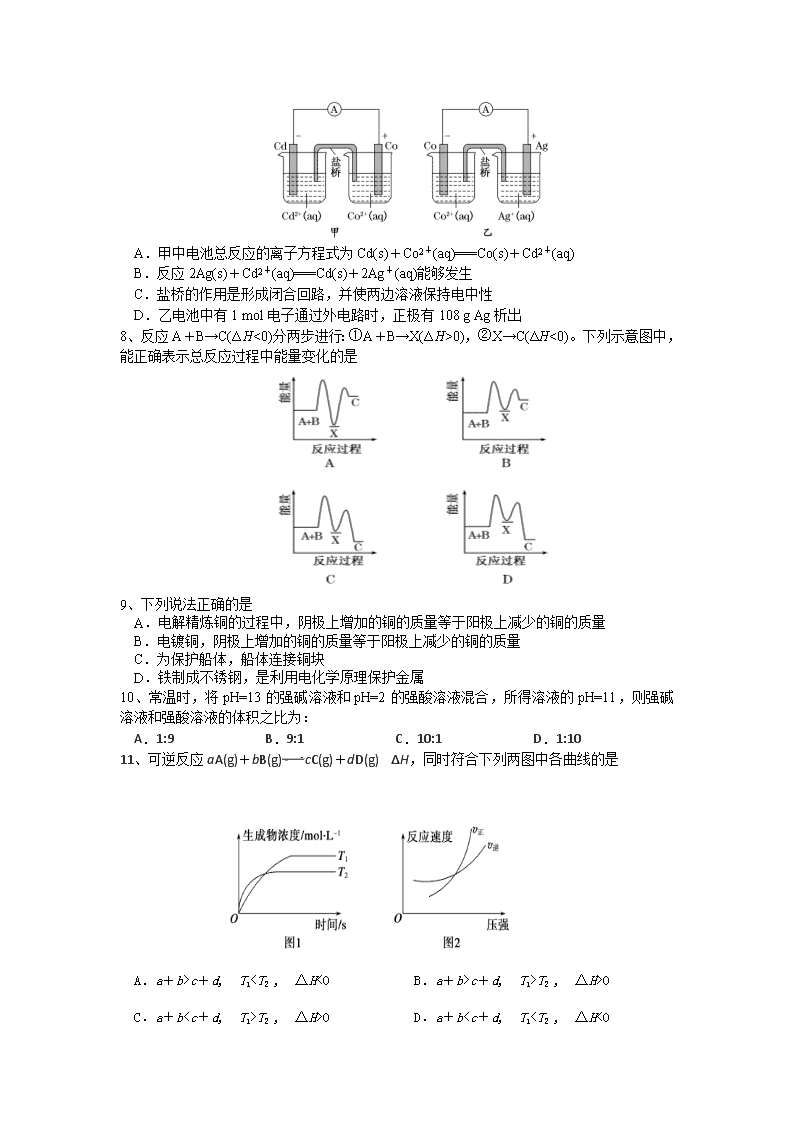
2016-2017学年度上学期期末考试 高二化学试题 命题人: 徐业广 可能用到的相对原子质量:H-1 C-12 O-16 S-32 Cl-35.5 Fe-56 Cu-64 Ag-108 第I卷(选择题,共48分) 1、Fe与稀H2SO4反应制氢气,下列措施能使生成氢气的速率一定加快的是 A.增加铁的量 B.用浓硫酸代替稀硫酸 C.加热 D.增大压强 2、在由水电离的c(H+)=10-14 mol/L的溶液中,一定能大量共存的离子组是 A.K+、Fe2+、SO、MnO B.Na+、Cl-、NO、SO C.Al3+、NH、Cl-、SO D.Na+、AlO、Br-、Cl- 3、依据甲、乙、丙三图,判断下列叙述不正确的是 A.甲是原电池,乙是电镀装置 B.甲、乙装置中,锌极上均发生氧化反应 C.乙装置中,铜极因发生氧化反应而溶解 D.乙装置中,c(Cu2+)不变,丙装置中,c(Cu2+)减小 4、升高温度,下列常数中不一定增大的是 A.电离常数Ka B. 化学平衡常数K C.水的离子积常数Kw D.盐的水解常数Kh 5、有一处于平衡状态的反应:X(s)+3Y(g)2Z(g) ΔH<0。为了使平衡向生成Z的方向移动,应选择的条件是 ①高温 ②低温 ③高压 ④低压 ⑤加催化剂 ⑥分离出Z A.①③⑤ B.②③⑤ C. ②④⑥ D.②③⑥ 6、下图的日常生活装置中,与华为手机充电时的能量转化形式相同的是 A.太阳能热水器 B.干电池 C.电解水 D.水力发电 7、如图所示,甲和乙均是双液原电池装置。判断下列说法不正确的是 A.甲中电池总反应的离子方程式为Cd(s)+Co2+(aq)===Co(s)+Cd2+(aq) B.反应2Ag(s)+Cd2+(aq)===Cd(s)+2Ag+(aq)能够发生 C.盐桥的作用是形成闭合回路,并使两边溶液保持电中性 D.乙电池中有1 mol电子通过外电路时,正极有108 g Ag析出 8、反应A+B→C(ΔH<0)分两步进行:①A+B→X(ΔH>0),②X→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是 9、下列说法正确的是 A.电解精炼铜的过程中,阴极上增加的铜的质量等于阳极上减少的铜的质量 B.电镀铜,阴极上增加的铜的质量等于阳极上减少的铜的质量 C.为保护船体,船体连接铜块 D.铁制成不锈钢,是利用电化学原理保护金属 10、常温时,将pH=13的强碱溶液和pH=2的强酸溶液混合,所得溶液的pH=11,则强碱溶液和强酸溶液的体积之比为: A.1:9 B.9:1 C.10:1 D.1:10 11、可逆反应aA(g)+bB(g)cC(g)+dD(g) ΔH,同时符合下列两图中各曲线的是 A.a+b>c+d, T1查看更多
相关文章
- 当前文档收益归属上传用户