- 2021-07-02 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2018-2019学年河南省河南大学附属中学高二下学期期中考试化学试题(解析版)
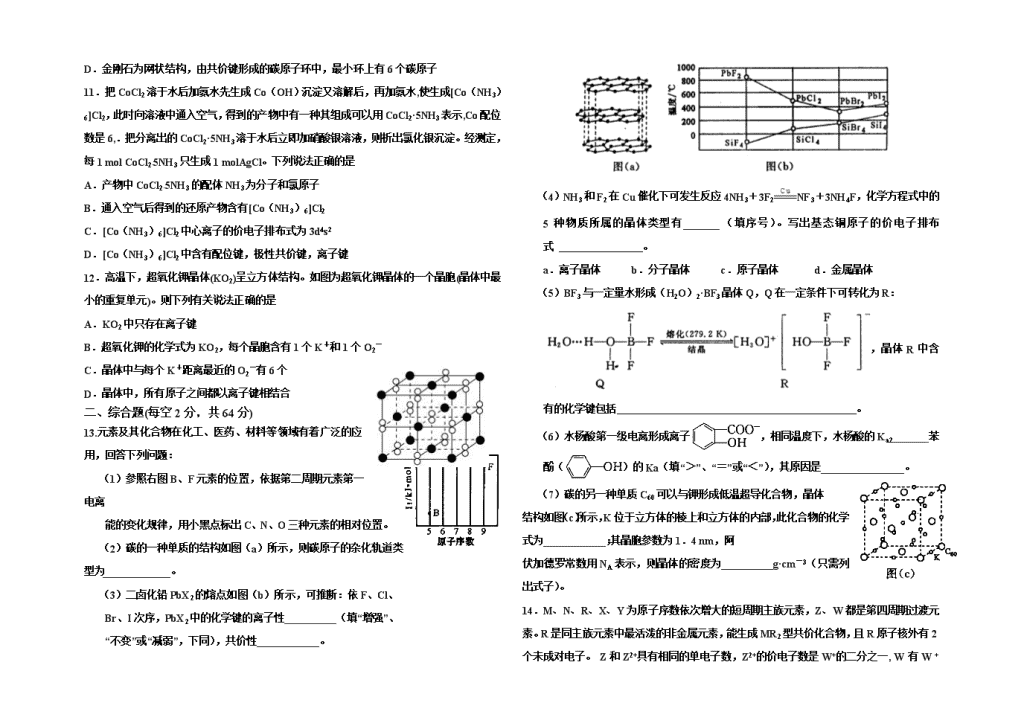
河南大学附属中学2018-2019学年高二下期期中 化学试题 60分钟100分 考查内容:人教版选修3《物质结构与性质》 可能用到的相对原子质量 K 39 C 12 Mn 55 S 32 Fe 56 O 16 一、 单项选择(每题3分,共36分) 1.下列说法不正确的是 A.氢键在形成蛋白质结构和DNA双螺旋结构中起关键作用 B.原子光谱可用于测定物质中元素的种类 C.门捷列夫为元素周期律和元素周期表的发现做出了突出贡献 D.空气、水、煤、天然气均为可再生资源 2.某原子第六电子层只有二个电子,其第五电子层电子数为 A.8 B.18 C.8~18 D.8~32 3.下列原子构成的单质中既能与稀硫酸反应,又能与烧碱溶液反应,且都产生H2的是 A.核内无中子的原子 B.外围电子排布为3s23p2 C.最外层电子数等于倒数第三层上的电子数的原子 D.N层上无电子,最外层上的电子数等于电子层数的原子 4.下列说法不正确的是 A.某金属元素气态基态原子的逐级电离能的数值分别为738、1451、7733、10540、13630、17995、21703……,当它与氯气反应时生成的阳离子是X2+ B.熔沸点:金刚石>纯铁>生铁>干冰 C.熔融状态的HgCl2不能导电,HgCl2的稀溶液有弱的导电能力且可作手术刀的消毒液,从不同角度分类HgCl2是一种共价化合物、非电解质、盐、离子晶体; D.含极性键的非极性分子往往是高度对称的分子,比如CO2、BF3、CH4这样的分子 5.下列叙述正确的是 A.2s轨道可以和3p轨道形成sp2杂化轨道 B.烯烃中的碳碳双键由l个σ键和l个π键组成 C.由极性键组成的分子,一定是极性分子 D.甲烷中心原子sp3杂化轨道有一个由孤电子对占据 6.Na3N是离子化合物,它和水作用可产生NH3。下列叙述正确的是 A.Na3N与盐酸反应生成的都是盐 B.Na+和N3-的电子层结构不相同 C.Na+的半径大于N3-的半径 D.在Na3N与水的反应中,Na3N做还原剂 7.下列客观事实与氢键无关的是 A.冰的密度比水小 B.H2O的分解温度比H2S高得多 C.液态氟化氢中有三聚氟化氢 D.NH3的沸点比PH3高 8.元素周期表的形式多种名样,如图是扇形元素周期表的一部分,下列说法正确的是 A.简单氢化物的沸点: ④>⑤>⑨ B.该表中标注的元素⑩处于第四周期ⅦB族 C.元素⑥和⑦的原子序数相差11 D.同温同压下,等质量的由元素⑤形成的两种气体单质含有相同的原子数 9.下列说法正确的是 A.Mg3N2晶体中的化学键是共价键 B.某物质含有离子键,则该物质在任何条件下均能导电 C.干冰是分子晶体,其气化过程中只需克服分子间作用力 D.常温常压下,气态单质分子中,每个原子的最外层都具有8电子稳定结构 10.下列关于原子晶体、分子晶体的叙述中,正确的是 A.在SiO2晶体中,1个硅原子和2 个氧原子形成2个共价键 B.晶体中分子间作用力越大,分子越稳定 C.HI 的相对分子质量大于HF,所以HI 的沸点高于HF D.金刚石为网状结构,由共价键形成的碳原子环中,最小环上有6个碳原子 11.把CoCl2溶于水后加氨水先生成Co(OH)沉淀又溶解后,再加氨水,使生成[Co(NH3)6]Cl2,此时向溶液中通入空气,得到的产物中有一种其组成可以用CoCl2·5NH3表示,Co配位数是6,.把分离出的CoCl2·5NH3溶于水后立即加硝酸银溶液,则析出氯化银沉淀。经测定,每1 mol CoCl2·5NH3只生成1 molAgCl。下列说法正确的是 A.产物中CoCl2·5NH3的配体NH3为分子和氯原子 B.通入空气后得到的还原产物含有[Co(NH3)6]Cl2 C.[Co(NH3)6]Cl2中心离子的价电子排布式为3d4s2 D.[Co(NH3)6]Cl2中含有配位键,极性共价键,离子键 12.高温下,超氧化钾晶体(KO2)呈立方体结构。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列有关说法正确的是 A.KO2中只存在离子键 B.超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O2- C.晶体中与每个K+距离最近的O2-有6个 D.晶体中,所有原子之间都以离子键相结合 二、综合题(每空2分,共64分) 13.元素及其化合物在化工、医药、材料等领域有着广泛的应用,回答下列问题: (1)参照右图B、F元素的位置,依据第二周期元素第一电离 能的变化规律,用小黑点标出C、N、O三种元素的相对位置。 (2)碳的一种单质的结构如图(a)所示,则碳原子的杂化轨道类型为_____________。 (3)二卤化铅PbX2的熔点如图(b)所示,可推断:依F、Cl、 Br、I次序,PbX2中的化学键的离子性__________(填“增强”、 “不变”或“减弱”,下同),共价性____________。 (4)NH3和F2在Cu催化下可发生反应4NH3+3F2NF3+3NH4F,化学方程式中的5种物质所属的晶体类型有_______(填序号)。写出基态铜原子的价电子排布式 。 a.离子晶体 b.分子晶体 c.原子晶体 d.金属晶体 (5)BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R: ,晶体R中含有的化学键包括 。 (6)水杨酸第一级电离形成离子,相同温度下,水杨酸的Ka2_______苯酚()的Ka(填“>”、“=”或“<”),其原因是________________。 (7)碳的另一种单质C60可以与钾形成低温超导化合物,晶体 结构如图(c)所示,K位于立方体的棱上和立方体的内部,此化合物的化学式为____________;其晶胞参数为1.4 nm,阿 伏加德罗常数用NA表示,则晶体的密度为__________g·cm-3(只需列出式子)。 14.M、N、R、X、Y为原子序数依次增大的短周期主族元素,Z、W都是第四周期过渡元素。R是同主族元素中最活泼的非金属元素,能生成MR2型共价化合物,且R原子核外有2个未成对电子。 Z和Z2+具有相同的单电子数,Z2+的价电子数是W+的二分之一, W 有W + 和W2+两种常见离子,R和X同主族。请回答下列问题(以下均用化学符号表示): (1)写出R基态原子的电子排布图___________ ______,M、N和R的电负性由小到大的顺序是________ ____。 (2)N的气态氢化物极易溶于R的氢化物,且该体系呈碱性,请用结构式表示出两者主要的结合方式_________ ________。 (3)在上述元素形成的分子中,有四种分子互为等电子体,分别是MR2、MX2和MRX以及_______,该分子的结构式为___________,N与Y形成的NY3分子的空间构型是________。 (4)M和R所形成MR2晶体以及W晶体的结构都可以如图表示(O表示一个MR2分子或一个W原子),晶体中正八面体和正四面体空隙数的比值是_________,Z的硫化物有3种晶体,其中一种是Z2+为面心立方堆积,而晶体中全部正四面体空隙的二分之一被S2-占据,如果两种离子核间距为acm,则该晶体密度为________ __________。 (5)Z的一种氧化物常用来氧化Y的氢化物的水化物的浓溶液制备Y2,该反应的化学方程式是______ ______。 15.物质结构决定性质,新材料的不断涌现有力地促进了社会进步,因此了解物质结构具有重要意义。试回答下列问题: (1)基态铁原子中未成对电子数为_________,在水溶液中常以Fe2+、Fe3+的形式存在,其中________更稳定。 (2)OF2中氧元素的化合价为__ __,中心原子的杂化方式为__ _,OF2的分子极性比H2O的__________(选填“大”或“小”)。 (3)一种新型铝离子电池中的电解质溶液由某种有机阳离子与AlCl4﹣、Al2Cl7﹣构成, AlCl4﹣的立体构型为_____ ____,Al2Cl7﹣中的原子都是8电子结构,则Al2Cl7﹣的结构式为(配位键用“→”表示)__ ________。 (4)FeO晶体与NaCl晶体结构相似,要比较FeO与NaCl的晶格能大小,还需要知道的数据是_______ ____; (5)氮化铝、氮化硼、氮化镓晶体的结构与金刚石相似,它们晶体的熔点由高到低的顺序是_______ ____。 (6)NH3分子中∠HNH键角为106.7º,而配离子[Zn(NH3)6]2+中∠HNH键角为109.5º, 配离子[Zn(NH3)6]2+中∠HNH键角变大的原因是__ ___。 (7)下图是Fe3O4晶体的晶胞。 ①晶胞中亚铁离子处于氧离子围成的___ ___(选填“正方形”、“正四面体”或“正八面体”)空隙。 ②晶胞中氧离子的堆积方式的名称为__ ______。 2018-2019学年下期期中高二化学试题答案 一、 单项选择 1.【答案】D 【解析】试题分析:A.氢键对维持生物大分子的空间构型和生理活性具有重要意义,所以氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用,A正确;B.用红外光谱仪可以确定物质中是否存在某些有机原子基团,用原子吸收光谱仪可以确定物质中含有哪些金属元素,B正确;C.门捷列夫为元素周期律和元素周期表的发现做出了突出贡献,C正确;D.煤、天然气均是化石燃料,是不可再生的,D错误,答案选D。 考点:考查氢键、物质结构测定、化学史以及能源判断等 2.【答案】C 【解析】试题分析:元素周期表各个周期包括的元素种数分别是2、8、8、18、18、32,第五周期包括的元素种类数是18种,若元素处于周期表的左边,则其第五电子层电子数为8个,若处于元素周期表的右侧,则其第五电子层电子数为18个.故选项是C。 考点:考查原子周期表的结构及各个周期包括的元素种类数的关系的知识。 3.【答案】D 【解析】A. 核内无中子的原子为氢,A错误;B. 外围电子排布为3s23p2的原子为硅,与稀硫酸不反应,B错误;C. 最外层电子数等于倒数第三层上的电子数的原子为镁,与碱不反应,C错误;D. N层上无电子,最外层上的电子数等于电子层数的原子为铍或铝,其单质均既能与稀硫酸反应,又能与烧碱溶液反应,且都产生H2,D正确,答案选D。 4.【答案】C 【解析】A、第三电离能数值远大于第二电离能,说明该金属元素是第ⅡA元素,因此与氯气反应时生成的金属阳离子是X2+,A正确;B、金刚石是原子晶体,纯铁是金属晶体,生铁是合金,熔点低于各成分金属熔点,干冰是分子晶体,所以熔沸点:金刚石>纯铁>生铁>干冰,B正确;C、HgCl2的稀溶液有弱的导电能力,说明在水分子的作用下HgCl2能够电离出自由移动的阴阳离子,且HgCl2的是化合物,属于电解质,C错误;D、CO2是直线形结构,BF3是平面三角形,CH4是正四面体结构,均是非极性分子,D正确,答案选C。 5.【答案】B 【解析】 A:能量相近轨道才可以杂化,不正确 B:正确 C:如果分子对称性好,极性键组成的分子也可能是非极性的分子 D:甲烷中心原子sp3杂化轨道中每个轨道有一个电子,没有孤对电子 答案为B 6.【答案】A 【解析】试题分析:A.根据与水反应的产物,可知Na3N与盐酸反应Na3N+4HCl=3NaCl+NH4Cl,生成氯化钠和氯化铵,故A正确;B.Na+和N3-离子核外电子数都是10,二者电子层结构相同,故B错误;C、Na+和N3-电子层结构相同,核电荷数越大离子半径越小,故Na+的半径小于N3-的半径,故C错误;D.Na3N与水的反应为:Na3N+H2O=NaOH+NH3↑,反应前后各元素化合价没变化,不是氧化还原反应,故D错误;故选A。 【考点定位】考查微粒半径大小的比较;原子核外电子排布;氧化还原反应 【名师点晴】本题考查了离子半径的大小比较、氧化还原反应、对信息的提取能力等,主要考查学生对信息应用的能力。电子层结构相同(核外电子排布相同)的离子半径(包括阴、阳离子)随核电荷数的增加而减小,如O2->F->Na+>Mg2+>Al3+。 7.【答案】B 【解析】A.冰中的氢键比水中的强,使得水分子排列得很规则,造成体积膨胀,密度变小,故A不选;B.物质的稳定性取决于键能的大小,而与氢键无关,故B选;C.因为HF的极性非常强,而且F原子的半径很小,因此在HF中会产生分子间氢键,通过氢键使得HF相互缔合成三聚氟化氢(HF)3分子,故C不选;D.氨分子间存在氢键,所以NH3的沸点比PH3高,故D不选;故选B。 点睛:氢键的存在对物质性质的影响:①分子间氢键的形成使物质的熔沸点升高.因物质熔化或液体气化时必须要破坏氢键.如:H2O比同族H2S的熔沸点高;②分子间形成的氢键对物质的水溶性、溶解度等也有影响.如NH3 极易溶于水,主要是氨分子与水分子之间已形成氢键;③水中氢键对水的密度的影响:水结成冰时体积会膨胀,密度减小。 8.【答案】D 【解析】由元素在周期表中的位置可知,①为H、②为Na、③为C、④为N、⑤为O、⑥为Mg、⑦为Al、⑧为S、⑨为Cl、⑩为Fe,则A. 水分子、氨气分子间存在氢键,则简单氢化物的沸点:⑤>④>⑨,A错误;B. 该表中标注的元素⑩是铁,处于第四周期Ⅷ族,B错误;C. 元素⑥和⑦的原子序数相差1,C错误;D. 同温同压下,等质量的由元素⑤形成的两种气体单质氧气和臭氧含有相同的原子数,D正确,答案选D。 9.【答案】C 【解析】 试题分析:A、氮化镁是离子晶体,其电子式为:Mg2+ N 3- Mg2+ N 3- Mg2+ ,故错误;B、离子化合物只能在熔融状态或水溶液才能导电,固体时不导电,故错误;C、干冰为分子晶体,气化时只需克服分子间作用力,故正确;D、如HCl,氢的最外层只有2个电子,故错误。 考点:考查化学键、电子式、晶体、8电子稳定结构等知识。 10.【答案】D 【解析】A. 在SiO2晶体中,1个硅原子和4个氧原子形成4个共价键,A不正确;B. 晶体中分子间作用力越大,其熔、沸点和硬度越高,但是与分子的稳定性没有关系,稳定性只与分子内的化学键的强度有关,B不正确;C. 虽然HI 的相对分子质量大于HF,但是,由于HF分子之间可以形成氢键,所以HF 的沸点高于HI,C不正确;D. 金刚石为网状结构,由共价键形成的碳原子环中,最小环上有6个碳原子,D正确。本题选D。 点睛:分子晶体在发生物理变化时只破坏分子间作用力,不破坏化学键,只有发生化学变化时才会破坏化学键,稳定性属于化学性质。氢键是一种特殊的分子间作用力,它比范德华力强得多,故氢键对物质性质的影响大于范德华力。 11.【答案】D 【解析】每1mol CoCl2·5NH3只生成1molAgCl,说明2个Cl―中只能电离出1个Cl―,由此可知,还有一个Cl―和NH3一样也用于形成了配体,CoCl2·5NH3的配体NH3为分子和氯离子,故A错误;CoCl2→[Co(NH3)6]Cl2元素化合价没变,所以[Co(NH3)6]Cl2不是还原产物,故B错误;[Co(NH3)6]Cl2中的中心离子是Co2+,价电子排布式为3d7,故C错误; Co与NH3是配位键、N-H是共价键、Co2+与Cl-是离子键,故D正确。 12.【答案】C 【详解】 A、K+离子与O2-离子形成离子键,O2-离子中O原子间形成共价键,故A错误; B、K+离子位于顶点和面心,数目为8×1/8+6×1/2=4,O2-离子位于棱心和体心,数目为12×1/4+1=4,即每个晶胞中含有4个K+和4个O2-,故B错误; C、由晶胞图可知,以晶胞上方面心的K+为研究对象,其平面上与其距离最近的O2-有4个,上方和下方各有一个,共有6个,故C正确; D、O原子间以共价键结合,故D错误。故选C。 【点睛】 易错点为C项,由晶胞图可知,以晶胞上方面心的K+为研究对象,其平面上与其距离最近的O2-有4个,上方和下方各有一个。 二、综合题 13.【答案】 (1) (2)sp2 (3)减弱;增强 (4)abd 3d104s1 (5)离子键、共价键、配位键 (6);中形成分子内氢键,使其更难电离出H+ (7)K3C60; 14.【答案】 C< N < O N2O N=N=O 三角锥型 1:2 261/16NAa3 MnO2+4HCl(浓) MnCl2+Cl2+2H2O 【解析】M、N、R、X、Y为原子序数依次增大的短周期主族元素, R是同主族元素中最活泼的非金属元素,且能生成MR2型共价化合物,R原子核外有2各未成对电子,则M为+4价,R为-2价,R和X同主族,因此R为O,M为C;X为S,则Y为Cl,N为N元素;Z、W都是第四周期过渡元素,W 有W +和W2+两种常见离子,则W为Cu元素;Z和Z2+具有相同的单电子数,Z2+的价电子数是W+的二分之一,则Z2+的价电子排布式为3d5,Z为Mn元素。 (1)R为O元素,基态O原子的电子排布图为;同周期的主族元素随核电荷数的增大,第一电离能呈增大的趋势,但氮的2p轨道为半充满结构,相对稳定,则C、N、O的电负性由小到大的顺序是C< N < O,故答案为: ;C查看更多
相关文章
- 当前文档收益归属上传用户