- 2021-07-02 发布 |
- 37.5 KB |
- 9页

申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
2019届二轮复习反应热电化学速率平衡善应用学案(全国通用)
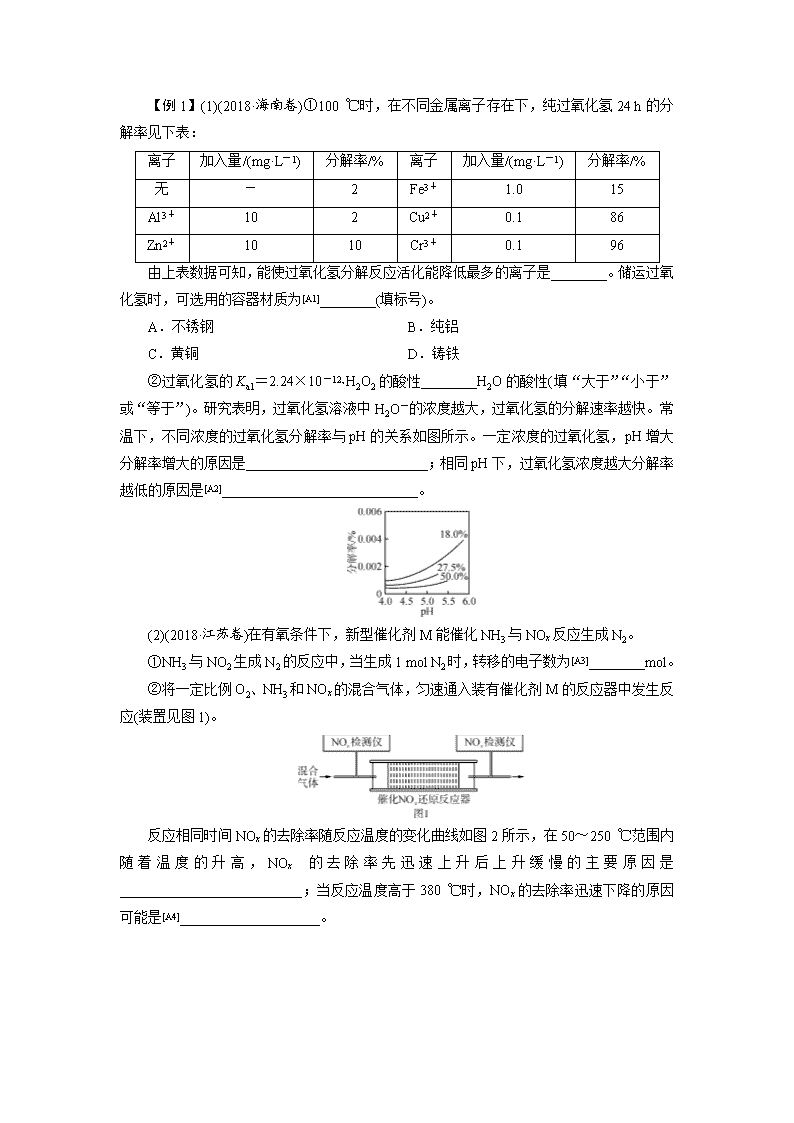
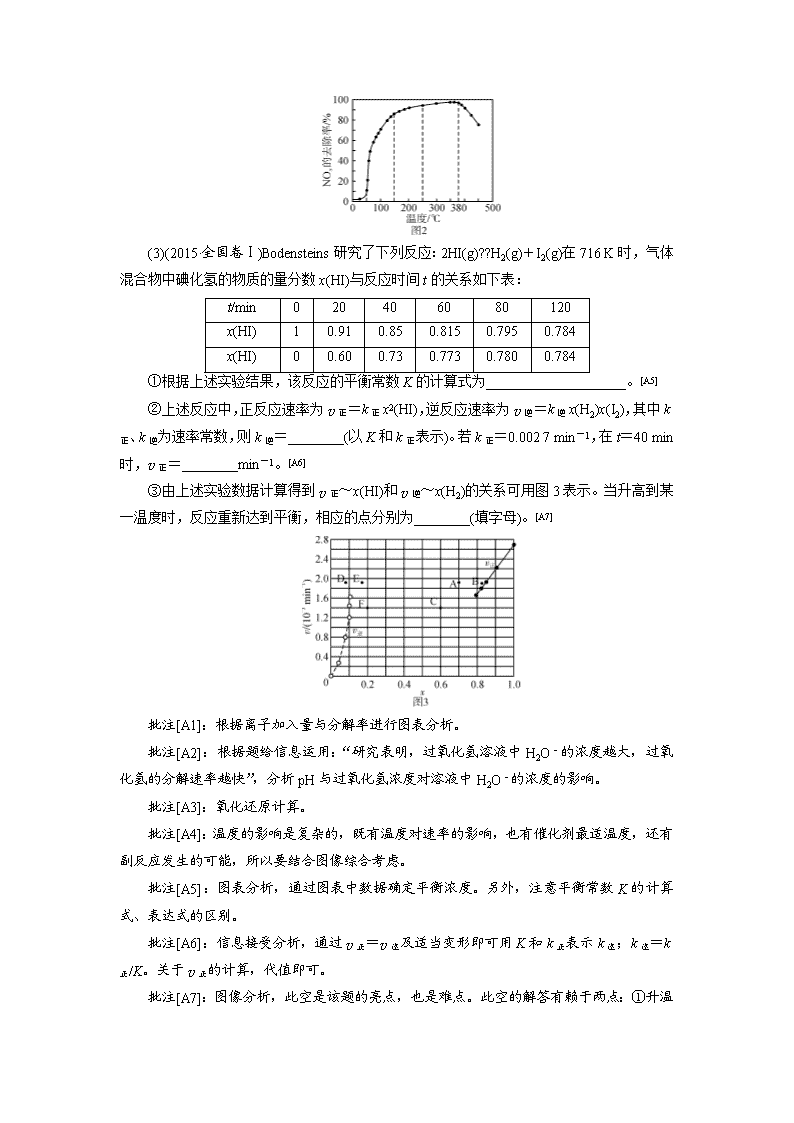
第二关 反应热 电化学 速率平衡善应用 盖斯律 正负极 三段式法全攻破 本题型一般取材于能源、环境问题、化工生产等情景,题目围绕一个主题,以“拼盘”的形式呈现,将热化学、化学反应速率、电化学及三大平衡知识融合在一起进行考查,每个小题相对独立;题目中结合图像、表格、数据、装置等信息,考查考生的阅读、识图、分析归纳能力,难度增加。考点主要涉及盖斯定律与热化学方程式、化学反应速率的计算及其影响因素分析、化学平衡移动及其影响因素分析、平衡常数计算及其影响因素分析、电极反应方程式书写等。主要考查“变化观念与平衡思想”“证据推理与模型认知”化学学科核心素养。 题型一 化学图表、图像等信息的提取和加工 1.图表类分析 …明确图表所呈现信息的化学含义(图表的含义),如物质的量浓度变化与时间二维关系。 ︱ …通过图表明确相应数学规律,即变化趋势等,如:正向或反向变化、极值点等。 ︱ …结合题意及图表规律分析确定其对应的化学原理,并提炼出相应变化规律及原因。 2.图像类分析 …明晰横、纵坐标所表示的化学含义,用变量的观点分析坐标,这是理解题意和进行正确思维的前提。 ︱ …找出曲线中的特殊点(起点、终点、顶点、拐点、交叉点、平衡点等),分析这些点所表示的化学意义以及影响这些点的主要因素及限制因素等,这些点往往隐含着某些限制条件或某些特殊的化学含义。 ︱ …正确分析曲线的走向、变化趋势?上升、下降、平缓、转折等?,同时对走势有转折变化的曲线,要分区段进行分析,研究找出各段曲线的变化趋势及其含义。 3.图像绘制类 在绘制图像时通常题目会有参考的曲线,在分析新条件与原曲线的关系的基础上进行绘制。 【例1】(1)(2018·海南卷)①100 ℃时,在不同金属离子存在下,纯过氧化氢24 h的分解率见下表: 离子 加入量/(mg·L-1) 分解率/% 离子 加入量/(mg·L-1) 分解率/% 无 - 2 Fe3+ 1.0 15 Al3+ 10 2 Cu2+ 0.1 86 Zn2+ 10 10 Cr3+ 0.1 96 由上表数据可知,能使过氧化氢分解反应活化能降低最多的离子是________。储运过氧化氢时,可选用的容器材质为[A1]________(填标号)。 A.不锈钢 B.纯铝 C.黄铜 D.铸铁 ②过氧化氢的Ka1=2.24×10-12, H2O2的酸性________H2O的酸性(填“大于”“小于”或“等于”)。研究表明,过氧化氢溶液中H2O-的浓度越大,过氧化氢的分解速率越快。常温下,不同浓度的过氧化氢分解率与pH的关系如图所示。一定浓度的过氧化氢,pH增大分解率增大的原因是__________________________;相同pH下,过氧化氢浓度越大分解率越低的原因是[A2]____________________________。 (2)(2018·江苏卷)在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。 ①NH3与NO2生成N2的反应中,当生成1 mol N2时,转移的电子数为[A3]________mol。 ②将一定比例O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中发生反应(装置见图1)。 反应相同时间NOx的去除率随反应温度的变化曲线如图2所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是__________________________;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是[A4]____________________。 (3)(2015·全国卷Ⅰ)Bodensteins研究了下列反应:2HI(g)??H2(g)+I2(g)在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表: t/min 0 20 40 60 80 120 x(HI) 1 0.91 0.85 0.815 0.795 0.784 x(HI) 0 0.60 0.73 0.773 0.780 0.784 ①根据上述实验结果,该反应的平衡常数K的计算式为____________________。[A5] ②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆=________(以K和k正表示)。若k正=0.002 7 min-1,在t=40 min时,v正=________min-1。[A6] ③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用图3表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为________(填字母)。[A7] 批注[A1]:根据离子加入量与分解率进行图表分析。 批注[A2]:根据题给信息运用:“研究表明,过氧化氢溶液中H2O-的浓度越大,过氧化氢的分解速率越快”,分析pH与过氧化氢浓度对溶液中H2O-的浓度的影响。 批注[A3]:氧化还原计算。 批注[A4]:温度的影响是复杂的,既有温度对速率的影响,也有催化剂最适温度,还有副反应发生的可能,所以要结合图像综合考虑。 批注[A5]:图表分析,通过图表中数据确定平衡浓度。另外,注意平衡常数K的计算式、表达式的区别。 批注[A6]:信息接受分析,通过v正=v逆及适当变形即可用K和k正表示k逆;k逆=k正/K。关于v正的计算,代值即可。 批注[A7]:图像分析,此空是该题的亮点,也是难点。此空的解答有赖于两点:① 升温对反应速率的影响(v正、v逆均增大)、升温对化学平衡的影响[平衡正移,即x(HI)减小、x(H2)增大];②结合图像寻找符合上述条件的点。 【解析】 (1)①根据表中数据可知:Cr3+加入量最少,但是分解率最高,可见催化效果最好,活化能降低最多;相反如果想储存过氧化氢,则应该选择分解率最低的金属离子对应的金属材料做容器。②Ka1=2.24×10-12,大于水的离子积常数,可见电离程度比水大,c(H+)大, H2O2的酸性强; 根据信息“过氧化氢溶液中H2O-的浓度越大,过氧化氢的分解速率越快”,可知pH增大,促进过氧化氢电离,溶液中H2O-的浓度增大,分解速率加快;而过氧化氢浓度越大,电离程度越小,分解率越小。 (2)①NH3与NO2的反应为8NH3+6NO27N2+12H2O,该反应中NH3中-3价的N升至0价,NO2中+4价的N降至0价,生成7 mol N2转移24 mol电子,则生成1 mol N2时转移电子数为 mol。②因为反应时间相同,所以低温时主要考虑温度和催化剂对化学反应速率的影响;高温时NH3与O2发生催化氧化反应。在50~250 ℃范围内,NOx的去除率迅速上升段是催化剂的活性随温度升高而增大与温度升高共同使NOx去除反应速率迅速增大;上升缓慢段主要是温度升高催化剂活性下降。反应温度高于380℃时,NOx的去除率迅速下降的原因可能是NH3与O2反应生成了NO,反应的化学方程式为4NH3+5O24NO+6H2O。 (3)①根据表格中数据分析知HI的起始物质的量为1 mol,120 min分解反应达平衡状态,HI的平衡物质的量为0.784 mol,三段式计算表示如下: 2HI(g) ?? H2(g) + I2(g) n0: 1 0 0 Δn: 0.216 0.108 0.108 n平: 0.784 0.108 0.108 2HI(g)?? H2(g)+I2(g)为气体体积不变的反应,K值计算如下:K=。 ②平衡时v正=v逆,k正x2(HI)=k逆x(H2)x(I2),则==K,则k逆=。若k正=0.002 7 min-1,在t=40 min时,v正=0.002 7 min-1×0.852=1.95×10-3 min-1。 ③该反应是吸热反应,升高温度,正逆反应速率增大,平衡正向移动,HI的物质的量分数降低,H2的物质的量分数升高,故平衡时,v正和v逆分别对应点A点、E点。 【答案】 (1)①Cr3+ B ②大于 pH升高,H2O-的浓度增大,分解速率加快 过氧化氢浓度增大,电离程度减小,分解率减小(2)① ②迅速上升段是催化剂活性随温度升高而增大与温度升高共同使NOx去除反应速率迅速增大;上升缓慢段主要是温度升高引起催化剂活性下降 NH3与O2反应生成了NO (3)①K=0.1082/0.7842 ②k正/K 1.95×10-3 ③A、E 题型二 化学反应原理的语言表达 (1)通读全题:明确题中有哪些考点,并弄清相关考点的上下文联系,如盖斯定律与平衡移动间的关系等。 (2)准确定位:即准确判断判定题中针对文字表达的知识点。通过题中所给信息确定文字表达知识点所涉及的化学原理、化学规律,如针对文字:速率变化、平衡移动、主副反应间关系等。该点是解决此类题目的重中之重,若能准确判断所考查的原理,则文字表述便是水到渠成。 (3)文字表述:先讲普遍原理,再结合本题论述。如某反应正向吸热,因此升温有利于该反应正向进行。 【例2】(1)(2017·全国卷Ⅱ)丁烯是一种重要的化工原料,可由丁烷催化脱氢[C4H10(g)===C4H8(g)+H2(g) ΔH>0]制备。 图(a) 图(b) ⅰ.丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(a)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的趋势,其降低的原因是__________________________[A8]。 ⅱ.图(b)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590 ℃之前随温度升高而增大的原因可能是____________________、____________________;590 ℃之后,丁烯产率快速降低的主要原因可能是______________________[A9]。 (2)(2016·全国卷Ⅱ)丙烯腈(CH2CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产。主要副产物有丙烯醛(CH2CHCHO)和乙腈(CH3CN)等。回答下列问题: ⅰ.以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下: ①C3H6(g)+NH3(g)+O2(g)===C3H3N(g)+3H2O(g) ΔH=-515 kJ·mol-1 ②C3H6(g)+O2(g)===C3H4O(g)+H2O(g) ΔH=-353 kJ·mol-1 两个反应在热力学上趋势均很大,其原因是______________________________[A10];有利于提高丙烯腈平衡产率的反应条件是_________________________[A11];提高丙烯腈反应选择性的关键因素是__________________________[A12]。 ⅱ.图(a)为丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460 ℃。低于460 ℃时,丙烯腈的产率________(填“是”或“不是”)对应温度下的平衡产率,判断理由是________________________[A13];高于460 ℃时,丙烯腈产率降低的可能原因是________(双选,填标号)[A14]。 A.催化剂活性降低 B.平衡常数变大 C.副反应增多 D.反应活化能增大 ⅲ.丙烯腈和丙烯醛的产率与n(氨)/n(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为________,理由是_____________________[A15]。进料气氨、空气、丙烯的理论体积比约为________[A16]。 批注[A8]:原理阐述题,抛物线类曲线单侧变化趋势分析。考查浓度对平衡移动的影响,即增大产物H2投料,平衡逆向移动。 批注[A9]:原理阐述题,抛物线类曲线两侧变化趋势分析。590 ℃之前,升温平衡正移、反应速率加快,丁烯产率增加;590 ℃之后,温度升高副反应加剧,丁烯产率减少。 批注[A10]:化学反应自发性的考查。 批注[A11]:平衡移动的考查。 批注[A12]:对于竞争反应,催化剂可以提高主反应的转化率。这一点,要注意与催化剂只能改变某一反应速率而不能改变该反应转化率的固有认识进行区分。 批注[A13]:原理阐述题,抛物线类曲线单侧变化趋势分析。注意温度对转化率的影响,放热反应温度越低转化率越高,抛物线左侧均为非平衡点。 批注[A14]:抛物线类曲线单侧变化趋势分析。升温导致丙烯睛产率降低的原因有二:① 动力学方面,催化剂活性降低;②热力学方面,平衡逆移。 批注[A15]:图像分析、原理阐述题,考查副反应变化趋势对主反应转化率的影响。此知识点告诉大家,影响转化率不仅要考虑平衡移动,也要考虑副反应的影响。 批注[A16]:简单计算,注意氧气在空气中比例即可。 【解析】 (1)ⅰ.由题意可知H2的作用是活化催化剂,同时是反应的产物,增大c(H2),促使平衡逆向移动,随着n(氢气)/n(丁烷)增大,逆反应速率增大,丁烯产率下降。ⅱ.温度升高则反应速率加快,相同时间内生成的丁烯会更多,同时由于反应是吸热反应,升高温度平衡正向移动,平衡体系中会含有更多的丁烯;当温度高于590 ℃时,因丁烯高温会裂解生成短链烃类,导致丁烯的产率降低。(2)ⅰ.由题意可知,反应①、②都是放热反应,反应①、②中1 mol 丙烯完全反应,分别放出515 kJ和353 kJ热量,两反应均符合化学反应自发进行的焓判据;反应①的正反应是气体体积增大的放热反应,由勒夏特列原理可知,降温、减压均能使反应①向正反应方向移动,提高丙烯腈平衡产率;催化剂具有高度的专一性,因此提高丙烯腈反应选择性的关键因素是催化剂,而非温度、压强。ⅱ.反应①的正反应是放热反应,如果已经达到化学平衡状态,当投料、压强、浓度等变量不变时,升温能使平衡逆向移动,丙烯腈的产率逐渐减小,读图可知,低于460 ℃时,丙烯腈的产率不是对应温度下的平衡产率。温度高于460 ℃时,催化剂活性可能降低,导致丙烯腈产率降低,选项A正确;反应①的正反应是放热反应,升温使平衡逆向移动,平衡常数逐渐变小,选项B错误;温度高于460 ℃时,副反应进行程度可能增大,反应①进行程度减小,导致丙烯腈产率降低,选项C正确;反应活化能与催化剂有关,与温度、压强、浓度等无关,升高温度,不能使反应活化能改变,选项D错误。ⅲ.读图可知,最佳n(氨)/n(丙烯)约为1,因为该比例下丙烯腈产率最高,而副产物丙烯醛产率最低。由反应①的热化学方程式可知,进料气中氨、氧气、丙烯气体的理论体积之比为1∶1.5∶1,空气中氧气的体积分数约为1/5(氮气约占4/5),则进料气中氨、空气、丙烯的理论体积比约为1∶(1.5÷1/5)∶1=1∶7.5∶1。 【答案】 (1)ⅰ.氢气是产物之一,随着n(氢气)/n(丁烷)增大,逆反应速率增大,平衡逆向移动 ⅱ.升高温度有利于反应向吸热方向进行温度升高反应速率加快丁烯高温裂解生成短链烃类 (2)ⅰ.两个反应均为放热量大的反应 降低温度降低压强 催化剂 ⅱ.不是 该反应为放热反应,平衡产率应随温度升高而降低 AC ⅲ.1 该比例下丙烯腈产率最高,而副产物丙烯醛产率最低 1∶7.5∶1 题型三 化学原理相关的计算 近年高考化学计算题注重计算能力以及从原理的角度确定计算的理论依据,因此应该掌握最常规的不同类型计算思路。 (1) 关系式法计算关键:多步反应以及滴定反应的计算题,可根据化学方程式、原子守恒、电子守恒等角度找出已知与未知的关系式,进行求算。 (2)“三段式”法:涉及化学平衡的平衡常数以及转化率的计算,按照“三段式”模型进行有序计算,把握“变化量”一定与计量系数成正比;起始量,平衡量或某时刻量则不一定成比例。 (3)“定义式”法:进行反应速率、电离常数、Ksp等计算时,一定要先写出定义式,再根据题意明确定义式中各物理量。 (4)“守恒”法:氧化还原及电化学计算,可根据电子得失守恒进行求解。 (5)“公式”法:反应热的计算,可以根据盖斯定律以及反应热与键能之间关系的公式进行计算。 【例3】(1)(2018·天津卷)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)2CO(g)+2H2(g) 已知上述反应中相关的化学键键能数据如下: 化学键 C—H CO H—H 键能/kJ·mol-1 413 745 436 1075 则该反应的ΔH=________。[A17]分别在V L恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是[A18]______(填“A” 或“B ”)。 (2)(2018·江淮十校联考)在25 ℃时,将b mol·L-1的KCN溶液与0.01 mol·L-1的盐酸等体积混合,反应达到平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度[A19]________0.01 mol·L-1(填“>”“<”或“=”);用含b的代数式表示HCN的电离常数Ka=________。[A20] (3)(2018·中原名校联考)某原电池装置如下图所示,电池总反应为2Ag+Cl2===2AgCl。 ①当电路中转移a mol e-时,交换膜左侧溶液中约减少[A21]________mol离子。交换膜右侧溶液中c(HCl)________(填“>”“<”或“=”)1 mol·L-1(忽略溶液体积变化)。 ②若质子交换膜换成阴离子交换膜,其他不变。若有11.2 L氯气(标准状况)参与反应,则必有________[A22]mol离子(填离子符号)由交换膜________侧通过交换膜向________侧迁移。交换膜右侧溶液中c(HCl)________(填“>”“<”或“=”)1 mol·L-1(忽略溶液体积变化)。 批注[A17]:考查焓变与键能间的关系。 批注[A18]:恒容与恒压的对比:关键抓住平衡后恒压容器与恒容容器容积的大小关系。 批注[A19]:二者等物质的量反应后显酸性。 批注[A20]:根据K的表达式,依据电荷守恒与物料守恒确定表达式中各微粒浓度。 批注[A21]:电路上电荷流量与通过交换膜的电荷量相同。 批注[A22]:通过阴离子交换膜的离子应该为Cl—。 【解析】 (1)化学反应的焓变应该等于反应物总键能减去生成物的总键能,所以焓变为(4×413+2×745)-(2×1075+2×436)=+120 kJ·mol-1。初始时容器A、B的压强相等,A容器恒容,随着反应的进行压强逐渐增大(气体物质的量增加);B容器恒压,压强不变;所以达平衡时压强一定是A中大,B中小,此反应压强减小平衡正向移动,所以B中反应进行更彻底,吸热也更多。(2)当c(KCN)=0.01 mol/L时,溶液成分为HCN和KCl,呈酸性。所以当呈中性时c(KCN)>0.01 mol/L。溶液呈中性可得出:c(K+)=c(Cl-)+c(CN-),c(CN-)=mol/L,Ka=== mol/L。 (3)①正极的电极反应式为Cl2+2e-===2Cl-,负极的电极反应式为Ag-e-+Cl-===AgCl,隔膜只允许氢离子通过,转移a mol电子,必有a mol Cl-沉淀。为了维持电荷平衡,交换膜左侧溶液中必有a mol H+向交换膜右侧迁移,故交换膜左侧共减少2a mol离子(a mol Cl-+a mol H+),交换膜右侧溶液中氯化氢浓度增大。 ②n(Cl2)=0.5 mol,n(Cl-)=1 mol,正极的电极反应式为Cl2+2e-===2Cl-,n(e-)=1 mol,Ag-e-+Cl-===AgCl,交换膜右侧溶液中增加了1 mol负电荷(或增加了1 mol Cl-),左侧减少了1 mol负电荷(或减少了1 mol Cl-)。如果质子交换膜换成阴离子交换膜,只允许阴离子(Cl-)通过交换膜,不允许H+通过。为了维持电荷平衡,必有1 mol Cl-从交换膜右侧溶液中通过交换膜向左侧迁移,氯离子迁移之后,两侧溶液中盐酸浓度保持不变。 【答案】(1)+120 kJ·mol-1 B (2)> (0.5b-0.005)×10-7/0.005(约简也对) (3)①2a > ②1 Cl- 右 左 =查看更多