- 2021-07-02 发布 |
- 37.5 KB |
- 7页


申明敬告: 本站不保证该用户上传的文档完整性,不预览、不比对内容而直接下载产生的反悔问题本站不予受理。
文档介绍
四川省泸县第四中学2019-2020学年高一下学期期中考试化学试题
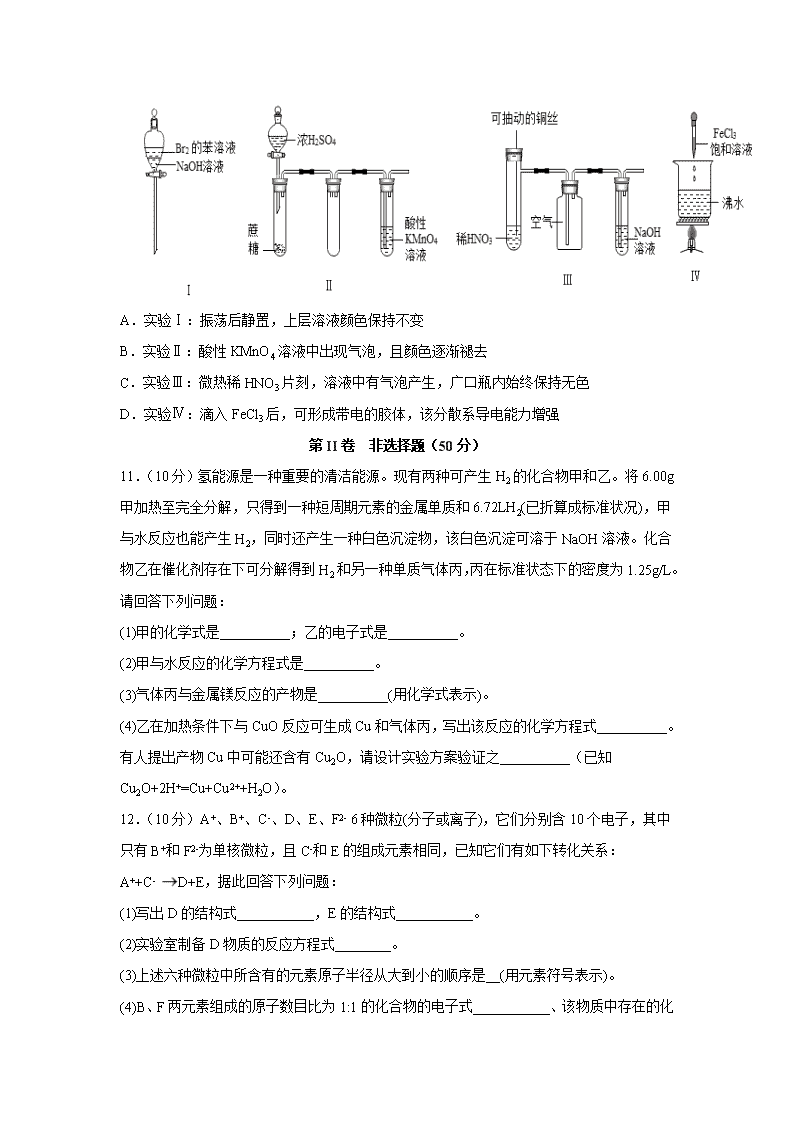
2020年春四川省泸县第四中学高一期中考试 化学试题 注意事项:1.答题前,考生先将自己的姓名、准考证号码填写清楚,将条形码准确粘贴在条形码区域内。 2.答题时请按要求用笔。 3.请按照题号顺序在答题卡各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试卷上答题无效。4.作图可先使用铅笔画出,确定后必须用黑色字迹的签字笔描黑。 5.保持卡面清洁,不要折叠、不要弄破、弄皱,不准使用涂改液、修正带、刮纸刀。 6.考试时间:150分钟;物理化学生物同堂分卷考试,每科100分,共300分 7.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Mg 23 P 31 S 32 Fe 56 Cu 64 第I卷 选择题(50分) 一、单选题(每小题5分,共10个小题,共50分) 1.下列有关化学用语表示正确的是 A.中子数为10的氧原子: B.S2Cl2中原子均满足8电子结构 C.硫化钠的电子式:NaNa D.H2O的电子式:H+[]2-H+ 2.下列反应属于吸热反应的是 ①二氧化碳与灼热的炭反应生成一氧化碳 ②葡萄糖在人体内被氧化分解 ③锌粒与稀H2SO4反应制取H2 ④Ba(OH)2·8H2O固体与NH4Cl固体反应 A.②④ B.① C.①③④ D.①④ 3.下列图中的实验,能达到实验目的的是 A. 证明稳定性:Na2CO3>NaHCO3 B. 证明非金属性:Cl>Br>I C. 验证镁和盐酸反应的热效应 D. 除去 Cl2 中的杂质气体 HCl 4.随着科学技术的不断进步,研究物质的手段和途径越来越多,H3、O4、C60、N5+等已被发现。下列有关说法中,正确的是 A.N5+中含有 24 个价电子 B.O2 与 O4 互为同位素 C.C60 分子中有范德华力 D.H2 与 H3 中存在氢键 5.氰酸铵(NH4OCN)与尿素[CO(NH2)2] A.都是共价化合物 B.都是离子化合物 C.互为同分异构体 D.互为同素异形体 6.对下列事实解释错误的是 A.向蔗糖中加入浓H2SO4后出现发黑现象,说明浓H2SO4具有脱水性 B.浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 C.常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 D.反应CuSO4+H2S=CuS↓+H2SO4能进行,说明硫化铜既不溶于水,也不溶于稀硫酸 7.下列关于物质性质变化的比较中不正确的是 A.酸性强弱:HIO4<HBrO4<HClO4 B.原子半径大小:Na>S>O C.碱性强弱:KOH>NaOH>LiOH D.还原性强弱F->Cl->I- 8.X、Y、Z三种非金属元素具有相同的电子层数,它们的气态氢化物的稳定性的强弱顺序为:XH3<H2Y<HZ,下列说法中正确的是 A.原子序数:X>Y>Z B.非金属性:X<Y<Z C.原子半径:X<Y<Z D.离子的还原性:X3-<Y2-<Z- 9.在离子RO3n-中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是 A.A-x+n+48 B.A-x+n+24 C.A-x-n-48 D.A+x-n-24 10.下列实验现象预测正确的是 A.实验Ⅰ:振荡后静置,上层溶液颜色保持不变 B.实验Ⅱ:酸性KMnO4溶液中出现气泡,且颜色逐渐褪去 C.实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 D.实验Ⅳ:滴入FeCl3后,可形成带电的胶体,该分散系导电能力增强 第II卷 非选择题(50分) 11.(10分)氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72LH2(已折算成标准状况),甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为1.25g/L。请回答下列问题: (1)甲的化学式是__________;乙的电子式是__________。 (2)甲与水反应的化学方程式是__________。 (3)气体丙与金属镁反应的产物是__________(用化学式表示)。 (4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式__________。有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之__________(已知Cu2O+2H+=Cu+Cu2++H2O)。 12.(10分)A+、B+、C-、D、E、F2- 6种微粒(分子或离子),它们分别含10个电子,其中只有B+和F2-为单核微粒,且C-和E的组成元素相同,已知它们有如下转化关系:A++C-D+E,据此回答下列问题: (1)写出D的结构式___________,E的结构式___________。 (2)实验室制备D物质的反应方程式________。 (3)上述六种微粒中所含有的元素原子半径从大到小的顺序是__(用元素符号表示)。 (4)B、F两元素组成的原子数目比为1:1 的化合物的电子式___________、该物质中存在的化学键有__。 13.(10分)下表标出的是元素周期表的一部分元素,回答下列问题: (1)除稀有气体外第三周期中原子半径最小的是_____(填元素符号) (2)表中用字母标出的12种元素中,化学性质最不活泼的是_____(用元素符号表示,下同),金属性最强的是___(用元素符号表示),属于过渡元素的是___(该空格用表中的字母表示) (3)元素B的单质含有的化学键为_____。(填“离子键’’、“极性共价键”、“非极性共价键”) (4)D、F元素最高价氧化物对应水化物相互反应的离子方程式为_____________ (5)为比较元素A和G的非金属性强弱,用图所示装置进行实验(夹持仪器已略去,装置气密性良好)。溶液B应该选用_____溶液,作用是_________,能说明A和G非金属性强弱的化学方程式是:________________________。 14.(10分)某实验小组同学进行如下实验,以检验化学反应中的能量变化。 (1)实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是______热反应, Ba(OH)2•8H2O与NH4Cl反应时,需要将固体研细其目的是________________.反应过程______ (填“①”或“②”)的能量变化可用图表示。 (2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是_________(填序号)。 (3)将CH4设计成燃料电池,其利用率更高,装置如图所示(a、b为多孔碳棒)其中____(填A或B)处电极入口通甲烷,其电极反应式为_____________________ 。当消耗标况下甲烷33.6L时,假设能量转化率为90%,则导线中转移电子的物质的量为_________mol。 (4)如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题: ①当电极c为Al、电极d为Cu、电解质溶液为稀硫酸时,写出该原电池正极的电极反应式为_______________。 ②当电极c为Al、电极d为Mg、电解质溶液为氢氧化钠溶液时,该原电池的正极为_______;该原电池的负极反应式为_____________________________。 15.(10分)某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,用如图所示装置进行有关实验: (1)B是用来收集实验中产生的气体的装置,但未将导管画全,请在图上把导管补充完整_________。 (2)实验中他们取6.4 g铜片和12 mL 18 mol·L−1浓硫酸放在圆底烧瓶中共热,直到反应完毕,最后发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余。 ①写出铜跟浓硫酸反应的化学方程式:__________________; ②为什么有一定量的余酸但未能使铜片完全溶解,你认为原因是__________________; ③下列药品中能够用来证明反应结束后的烧瓶中确有余酸的是________(填编号)。 A.铁粉 B.BaCl2溶液 C.银粉 D.Na2CO3溶液 (3)装置C中试管D内盛装的是品红溶液,当B中气体收集满后,有可能观察到的现象是_____________,待反应结束后,向C中烧杯内加入沸水,D中观察到的现象是_____________。 (4)实验装置C有可能造成环境污染,试用最简单的方法加以解决__________________(实验用品自选)。 2020年春四川省泸县第四中学高一期中考试 化学试题参考答案 1.B 2.D 3.C 4.A 5.C 6.C 7.D 8.B 9.B 10.B 11.AlH3 AlH3+3H2O=Al(OH)3↓+3H2↑ Mg3N2 2NH3+3CuO3Cu+N2+3H2O 将固体溶于稀硫酸中,如果溶液变蓝,说明产物中含有Cu2O,反之则无Cu2O 13.Cl Ar Na M 非极性共价键 Al(OH)3+OH﹣═AlO2﹣+2H2O 饱和NaHCO3 除去CO2中的HCl杂质 CO2+H2O+Na2SiO3=Na2CO3+H2SiO3↓ 14.放 扩大接触面积,提高反应速率 ① ② A CH4﹣8e—+10OH﹣=CO32—+7H2O 10.8 2H++2e—═H2↑ Mg Al+4OH—﹣3e—=AlO2—+2H2O 15. Cu+2H2SO4(浓)CuSO4+2H2O+SO2↑ 随着反应进行,硫酸被消耗,产物有水生成,所以浓硫酸变成稀硫酸,反应停止 AD 红色褪去 恢复红色 用浸有NaOH的溶液的面团塞在试管口 查看更多